题目内容
9.某化学小组为了证明SO2和Cl2的漂白性,设计了如图1所示的实验装置: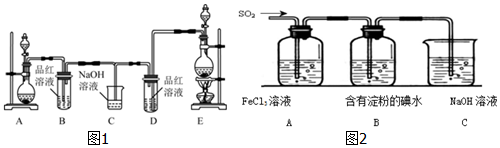
(1)他们制备Cl2依据的原理是:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,应选用图A、E装置中的E(填序号)制Cl2,反应中浓盐酸所表现出的性质是酸性、还原性.
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是溶液又变为红色.
(NaOH溶液分别与两种气体反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O、SO2+2OH-=SO32-+H2.
(3)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色.查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是SO2+Cl2+2H2O=H2SO4+2HCl.
(4)下列五种有色溶液与SO2作用,均能褪色,其反应实质相同的是D
①品红溶液②酸性KnO4溶液③溴水④滴入酚酞的烧碱溶液⑤淀粉一碘溶液
A.①②③B.②③④C.③④⑤D.②③⑤
(5)某兴趣小组为探究SO2气体的还原性,他们使用的药品和装置如图2所示,下列说法不合理的是C
A.如果B中蓝色溶液褪色则能表明SO2的还原性强于I-
B.装置C的作用时吸收SO4尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入KMnO4溶液,看紫红色是否褪去
D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀.
分析 (1)根据反应条件选择装置,根据方程式可以判断浓盐酸的性质;
(2)二氧化硫能够使品红溶液褪色,但是不稳定受热易恢复颜色;氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;二氧化硫与氢氧化钠反应生成亚硫酸钠;
(3)二氧化硫有还原性,氯气有氧化性,根据SO2与Cl2以体积比1:1写反应;
(4)二氧化硫为酸性氧化物,能与碱性氧化物、碱发生反应;二氧化硫能漂白某些有色物质,如使品红溶液褪色;二氧化硫中硫为+4价,属于中间价态,有氧化性又有还原性,以还原性为主,如二氧化硫能使氯水、溴水、KMnO4溶液褪色,体现了二氧化硫的强还原性而不是漂白性;
(5)A、B中蓝色褪去,说明二氧化硫和碘单质反应,依据氧化还原反应中还原剂的还原性大于还原产物分析;
B、二氧化硫是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收;
C、二氧化硫、亚铁离子都具有还原性,都可以和高锰酸钾溶液发生反应使之褪色;
D、铁离子氧化二氧化硫为硫酸,加入氯化钡生成沉淀说明反应进行.
解答 解:(1)实验室制氯气应是固体和液体加热生成;又由反应4molHCl中有2mol盐酸中的氯元素化合价升高,做还原剂,表现还原性,还有2mol化合价不变与金属阳离子结合成盐表现出酸性;
故答案为:E;酸性、还原性;
(2)A装置生成二氧化硫使品红溶液褪色,但是不稳定受热易恢复颜色;氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,二氧化硫与氢氧化钠反应生成亚硫酸钠,离子反应方程式为:SO2+2OH-=SO32-+H2O;
故答案为:溶液又变为红色;Cl2+2OH-=Cl-+ClO-+H2O;SO2+2OH-=SO32-+H2O;
(3)二氧化硫有还原性,氯气有氧化性,SO2与Cl2以体积比1:1混合后通入水中,发生氧化还原反应:SO2+Cl2+2H2O=H2SO4+2HCl;
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(4)①二氧化硫使品红溶液褪色体现其漂白性;
②二氧化硫使酸性KMnO4溶液褪色,体现其还原性;
③二氧化硫使溴水褪色,体现其还原性;
④二氧化硫使滴入酚酞的烧碱溶液褪色,是因为二氧化硫为酸性氧化性,与氢氧化钠反应;
⑤二氧化硫使淀粉-碘溶液褪色,体现其还原性;
所以反应实质相同的是②③⑤;
故答案为:D;
(5)A、B中蓝色褪去,说明二氧化硫和碘单质反应,I2+SO2+2H2O=2HI+H2SO4,依据氧化还原反应中还原剂的还原性大于还原产物,二氧化硫还原性大于碘离子,故A正确;
B、二氧化硫是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,故B正确;
C、二氧化硫、亚铁离子都具有还原性,都可以和高锰酸钾溶液发生反应使之褪色,不能验证A中发生了氧化还原反应,故C错误;
D、铁离子氧化二氧化硫为硫酸,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,加入氯化钡生成沉淀说明反应进行生成了硫酸根离子,故D正确;
故答案选:C.
点评 本题考查了氯气的实验室制备,次氯酸和二氧化硫的漂白性,二氧化硫、铁及其化合物性质分析判断,难度不大,掌握基础是关键.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 | |
| B. | 向ZnS沉淀上滴加CuSO4溶液沉淀变为黑色,可推知同温下Ksp(ZnS)<Ksp(CuS) | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应方程式为2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq) | |
| D. | 向2mL浓度均为1.2mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,振荡沉淀呈黄色,说明Ksp(AgCl)>Ksp(AgI) |
| A. | 稀释溶液,$\frac{c(HC{O}_{3}^{-}C)•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$不变 | |
| B. | 通入CO2,溶液pH增大 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 加入NaOH固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 |
| A. | 氧化铁可用作红色油漆和涂料 | B. | 氧化铝可制耐高温实验材料 | ||
| C. | 明矾可用作净水剂 | D. | 用铝制餐具长时间存放碱性食物 |
| A. | 足量的CO2和水蒸气的混合气体与少量的Na2O2充分反应,最终必生成NaOH | |
| B. | 足量的MnO2与含4molHCl的浓盐酸加热充分反应,产生的Cl2必为1mol | |
| C. | 含2molHCl的某盐酸滴入足量的碳酸钠溶液中充分反应后,得到CO2气体必为1mol | |
| D. | 过量的二氧化碳通入偏铝酸钠溶液中,最终生成的产物必为Al(OH)2和碳酸氢钠 |
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)X元素在周期表中的位置为第三周期ⅣA族,表中元素原子半径最小的是氧元素(填元素名称).
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)表中某元素的气态氢化物与该元素的最高价氧化物对应的水化物可以反应,写出该反应的化学方程式为NH3+HNO3=NH4NO3.
(4)向盛有少量氢硫酸溶液的试管中通入二氧化硫气体,在实验结束后发现试管内壁上沾有黄色粉末,则清洗该试管的方法是向试管中加入少量CS2并充分振荡(或向试管中加入少量NaOH溶液并加热).
(5)已知元素Na与元素Y可形成原子个数比为1:1的二元离子化合物,写出该化合物的电子式
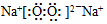 ,该化合物中的化学键类型有离子键、(非极性)共价键.
,该化合物中的化学键类型有离子键、(非极性)共价键.(6)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式C(s)+2Cl2(g)=CCl4(l)△H=-687kJ/mol.
| A. | 实验室制氯气:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 实验室制二氧化硫:Cu+SO42-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 实验室用浓氨水与生石灰制氨气:NH3•H2O+CaO═Ca(OH)2+NH3↑ | |
| D. | 实验室制二氧化氮:3Cu+4H++2NO3-═3Cu2++2NO2↑+2H2O |