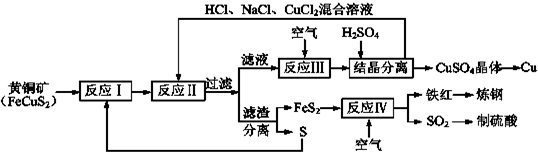
题目内容
15.将等体积等物质的量浓度的氨水和盐酸混合后,溶液呈酸性(填“酸性”,“中性”或“碱性”),溶液中c(NH4+)<c(Cl-)(填“>”或“=”或“<”).若将pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈酸性 (填“酸性”,“中性”或“碱性”),溶液中c(Na+)< c(CH3COO-) (填“>”或“=”或“<”).分析 一水合氨是一元碱,盐酸是一元酸,等体积、等物质的量浓度的氨水和盐酸恰好反应生成氯化铵,根据盐类水解确定溶液酸碱性,pH=3的醋酸,其浓度大于0.001mol/L,pH=11的氢氧化钠,其浓度等于0.001mol/L,等体积混合后,醋酸过量;根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),醋酸过量,溶液呈酸性,所以c(H+)>C(OH-).
解答 解:一水合氨是一元碱,盐酸是一元酸,等体积、等物质的量浓度的氨水和盐酸恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解而导致其溶液呈酸性,所以其pH<7,溶液中c(NH4+)<c(Cl-),
pH=3的醋酸,其浓度大于0.001mol/L,pH=11的氢氧化钠,其浓度等于0.001mol/L,等体积混合后,醋酸过量,为醋酸和醋酸钠的混合溶液,则溶液显酸性,
醋酸过量,溶液呈酸性,所以c(H+)>C(OH-),根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(Na+)<c(CH3COO-),
故答案为:酸性,<; 酸性,<;
点评 本题考查了酸碱混合溶液定性判断,根据盐中“谁强谁显性、谁弱谁水解、强强显中性”确定氯化铵溶液酸碱性,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列叙述与胶体的性质无关的是( )
| A. | 江河入海口容易形成三角洲 | |
| B. | 当日光从窗隙射入暗室时,可观察到一束光线 | |
| C. | 向氢氧化铁与水形成的某分散系中插入正、负电极,通直流电一段时间后,一极附近颜色变深 | |
| D. | 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
7.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 23 g Na变为Na+时得到的电子数为NA | |
| B. | 18 g水所含的电子数为NA | |
| C. | 16 g O2与16 g O3所含的原子数均是NA | |
| D. | 常温常压下,46 g的NO2和N2O4混合气体含有的分子数为3NA |
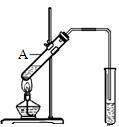 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质: .
.