题目内容
5.用学过的化学知识解答下列问题:(1)下列物质中,含离子键和非极性键的是⑥,属于共价化合物的是③④(填序号).
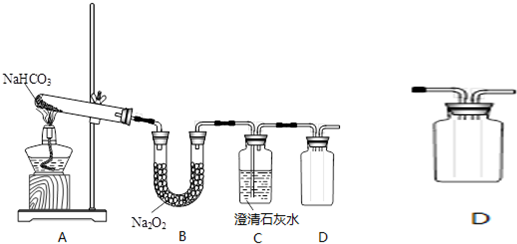
①N2 ②MgCl2 ③CO2 ④HNO3 ⑤KOH ⑥Na2O2
(2)硼在自然界有10B、11B两种核素,它们之间的关系互为同位素,已知硼元素的近似相对原子质量为10.8,则10B与11B的原子个数之比为1:4.
(3)若R2-原子核内有x个中子,其质量数为A,则n g R2-所含电子的物质的量为$\frac{n(A-N+2)}{A}$.
分析 (1)根据离子键、共价键、离子化合物、共价化合物的定义分析;
(2)10B、11B两种核素,质子数相同,中子不同的原子互称为同位素;硼元素的相对原子质量是10.8,则硼元素的摩尔质量是10.8g/mol,再根据$\overline{M}$=$\frac{m}{n}$计算其物质的量之比,再根据物质的量计算其质量分数;
(3)R原子的质量数为A,则其摩尔质量为Ag/mol,根据n=$\frac{m}{M}$计算原子的物质的量;质量数=质子数+中子数,再由阴离子R2-核外有N个中子,则质子数为A-N,阴离子中:质子数+所带电荷数=核外电子数,该离子的核外电子总数为A-N+2,以此解答该题.
解答 解:(1)①N2只含非极性的单质;
②MgCl2只含离子键的化合物;
③CO2只共价键的化合物;
④HNO3只含共价键的化合物;
⑤KOH既含离子键和极性键共价键;
⑥Na2O2既含离子键和非极性键共价键;
故答案为:⑥; ③④;
(2)有10B、11B两种核素,它们之间的关系互为同位素;硼元素的相对原子质量是10.8,则硼元素的摩尔质量是10.8g/mol,
设10B和11B的物质的量分别是xmol、ymol,则$\overline{M}$=$\frac{10g/mol×xmol+11g/mol×ymol}{(x+y)mol}$=10.8g/mol,x:y=1:4,故答案为:同位素;1:4;
(3)R原子的质量数为A,则其摩尔质量为Ag/mol,根据n=$\frac{m}{M}$计算原子的物质的量;质量数=质子数+中子数,再由阴离子R2-核外有N个中子,则质子数为A-N,阴离子中:质子数+所带电荷数=核外电子数,该离子的核外电子总数为A-N+2,所以mg Rn-电子的物质的量为:$\frac{n}{A}$mol×(A-N+2)=$\frac{n(A-N+2)}{A}$mol,故答案为:$\frac{n(A-N+2)}{A}$.
点评 本题考查学生利用原子构成的简单计算,题目难度不大,明确原子的物质的量的计算是解答本题的关键,注意电子的质量可忽略,质量数近似等于相对原子质量.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案| A. | ③④⑤⑧ | B. | ④⑤⑧ | C. | ④⑤⑦⑧ | D. | ③④⑤⑦⑧ |
| A. | 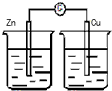 稀H2SO4 | B. | 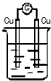 AgNO3 | C. | 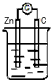 甘油 | D. | 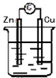 稀H2SO4 |

| A. | 该反应是吸热反应 | |
| B. | 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 | |
| C. | 断裂1 mol A-A键和1 mol B-B键能放出x kJ能量 | |
| D. | 断裂2 mol A-B键需要吸收y kJ的能量 |
| A. | 淀粉、纤维素都属天然高分子化合物 | |
| B. | 食品包装袋中可用碱石灰做干燥剂 | |
| C. | 煤经过液化等物理变化可转化为清洁燃料 | |
| D. | 制作航天服的聚醋纤维属新型无机非金属材料 |
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | “神舟十号”宇宙飞船返回舱外表面主要是导电导热良好的新型金属材料钛合金 | |
| C. | “天宫一号”是中国第一个空间实验室,其太阳能电池板的主要材料是硅 | |
| D. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
| A. | Na2O2固体中阴、阳离子个数比为1:1 | |
| B. | 由酸性HCl>H2CO3,可推知非金属性Cl>C | |
| C. | pH均为5的CH3COOH溶液和NH4Cl溶液中水的电离程度相同 | |
| D. | 常温下,浓度均为0.1mol/L的HA酸溶液与NaOH溶液等体积混合后(pH约为8),溶液中离子浓度关系:c(Na+)>c(A-)>c(OH-)>c(H+) |
 (R,R′为烃基或氢)
(R,R′为烃基或氢) (R,R′为烃基)
(R,R′为烃基) .
.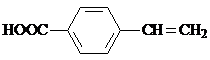 .
. .
.