题目内容
16.某实验小组拟验证CO2与Na2O2反应的产物,现设计以下实验装置进行实验: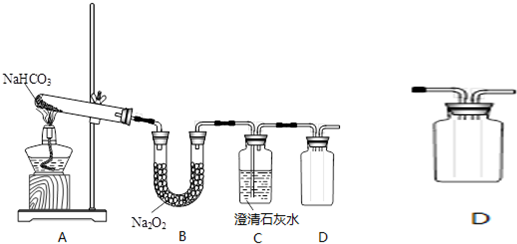
(1)写出装置A中反应的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
写出装置B中反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2.
(2)拟用装置D收集气体产物,请在方框中将装置补充完整.
(3)产物检验:检验气体产物的方法:用带火星的小木条靠近集气瓶D出口处,木条复燃;
(4)有同学认为该实验装置存在明显缺陷,你认为该缺陷是什么2Na2O2+2H2O=4NaOH+O2↑(用化学方程式表示)
分析 碳酸氢钠在加热条件下分解生成碳酸钠、水和二氧化碳气体,生成的二氧化碳气体通入过氧化钠发生2Na2O2+2CO2═2Na2CO3+O2,因二氧化碳中水没有排除,还发生2Na2O2+2H2O=4NaOH+O2↑,通过澄清石灰水,可除去二氧化碳,生成的氧气用向上排空法收集,以此解答该题.
(1)装置A中碳酸氢钠受热分解生成碳酸钠和水、二氧化碳;装置B中,二氧化碳和过氧化钠反应生成碳酸钠和氧气;
(2)装置D收集气体为氧气,用向上排空气法收集,导管应长进短出;
(3)根据氧气具有助燃性选择检验的方法;
(4)二氧化碳中水没有排除,水也能与过氧化钠反应生成氧气.
解答 解:碳酸氢钠在加热条件下分解生成碳酸钠、水和二氧化碳气体,通入过氧化钠发生2Na2O2+2CO2═2Na2CO3+O2,通过澄清石灰水,可除去二氧化碳,生成的氧气用向上排空法收集.
(1)碳酸氢钠在加热条件下分解生成碳酸钠、水和二氧化碳气体,发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,装置B中反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;2Na2O2+2CO2═2Na2CO3+O2;
(2)装置D收集氧气,氧气的密度大于空气,需用向上排空法收集,导管应长进短出,如图 ,
,
故答案为: ;
;
(3)检验氧气,可用带火星的小木条靠近集气瓶D出口处,木条复燃,则说明生成氧气,
故答案为:用带火星的小木条靠近集气瓶D出口处,木条复燃;
(4)因二氧化碳中水没有排除,还发生2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查过氧化钠与二氧化碳反应的实验,为高考常见题型和高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及实验的原理,题目难度中等.

| A. | △H<0的反应均是自发反应 | |
| B. | 自发进行的反应一定能迅速进行 | |
| C. | 高锰酸钾加热分解是一个熵减小的过程 | |
| D. | 冰在室温下自动熔化成水,是熵增的重要结果 |
Zn+2OH--2e-═ZnO+H2O,
Ag2O+H2O+2e-═2Ag+2OH-
据此判断,下列说法正确的是( )
| A. | Ag2O作正极,被氧化 | |
| B. | 若将电解液换成酸性溶液,使用寿命会缩短 | |
| C. | Zn作正极,被还原 | |
| D. | OH-向正极移动 |
| A. | CO2(CO):通O2,点燃 | B. | CO(CO2):通过NaOH溶液 | ||
| C. | N2(O2):通过灼热的CuO | D. | CaO(CaCO3):加水,再过滤 |
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L•min) | |
| D. | 反应吸收0.025Q kJ热量时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好完全反应 |
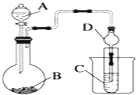 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.