题目内容
13.下列装置能构成原电池的是( )| A. | 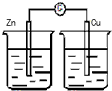 稀H2SO4 | B. | 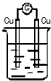 AgNO3 | C. | 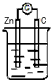 甘油 | D. | 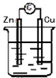 稀H2SO4 |
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答 解:A、该装置不能构成闭合回路,所以不能构成原电池,故A错误;
B、没有两个活泼性不同的电极,所以不能构成原电池,故B错误;
C、甘油不是电解质,锌和甘油不能自发的进行氧化还原反应,所以不能构成原电池,故C错误;
D、该装置符合原电池的构成条件,所以能形成原电池,故D正确;
故选D.
点评 本题考查了原电池的构成条件,难度不大,注意这几个条件必须同时存在才能形成原电池,缺一不可.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
3.下列分子晶体中,关于熔、沸点高低的叙述正确的是( )
| A. | H2>N2>O2 | |
| B. | NH3>AsH3>PH3 | |
| C. | Cl2>Br2>I2 | |
| D. | C(CH3)4>(CH3)2CHCH2CH3>CH3CH2CH2CH2CH3 |
4.人造地球卫星用到的一种高能电池-银锌电池,它在放电时的电极反应为:
Zn+2OH--2e-═ZnO+H2O,
Ag2O+H2O+2e-═2Ag+2OH-
据此判断,下列说法正确的是( )
Zn+2OH--2e-═ZnO+H2O,
Ag2O+H2O+2e-═2Ag+2OH-
据此判断,下列说法正确的是( )
| A. | Ag2O作正极,被氧化 | |
| B. | 若将电解液换成酸性溶液,使用寿命会缩短 | |
| C. | Zn作正极,被还原 | |
| D. | OH-向正极移动 |
1.下列是除去括号内杂质的有关操作,其中正确的是( )
| A. | CO2(CO):通O2,点燃 | B. | CO(CO2):通过NaOH溶液 | ||
| C. | N2(O2):通过灼热的CuO | D. | CaO(CaCO3):加水,再过滤 |
18.下列关于化学反应速率的说法正确的是( )
| A. | 因是同一反应,所以用不同物质表示化学反应速率时,所得数值是相同的 | |
| B. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| C. | 化学反应速率为“1 mol/(L•min)”表示的意思是:时间为1 min 时,某物质的浓度为1 mol/L | |
| D. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加 |
3.在某温度下,向三个初始体积均为1L的密闭容器中按下表所示投料,发生反应:2SO2(g)+O2(g)═2SO3(g)△H<0.达到平衡时,下列说法正确的是( )
| 容器编号 | 容器类型 | 起始物质的量/mol | 平衡时SO3的物质的量/mol | ||
| SO2 | O2 | SO3 | |||
| Ⅰ | 恒温恒容 | 2 | 1 | 0 | 1.2 |
| Ⅱ | 绝热恒容 | 0 | 0 | 2 | a |
| Ⅲ | 恒温恒压 | 2 | 1 | 0 | b |
| A. | 平衡时SO3的物质的量:a>1.2、b>1.2 | |
| B. | 容器Ⅱ、Ⅲ中平衡常数相同 | |
| C. | 容器 I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1 | |
| D. | 若起始时向容器Ⅰ中充入1.0mol SO2 (g)、0.40mol O2(g)和1.40mol SO3 (g),则此时ν正<ν逆 |
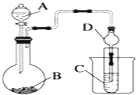 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.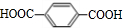 +2NaHCO3→
+2NaHCO3→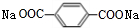 +2H2O+2CO2↑.
+2H2O+2CO2↑.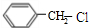 .
.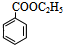 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$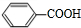 +CH3CH2OH.
+CH3CH2OH.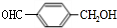 ,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n
,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$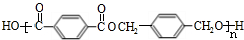 +(2n-1)H2O.
+(2n-1)H2O.