题目内容
12.下列对碱性锌锰电池的叙述不 正确的是( )| A. | 锌是正极,MnO2是负极 | |
| B. | 电解质是KOH溶液 | |
| C. | 锌发生氧化反应,MnO2发生还原反应 | |
| D. | 它的能量和储存时间比普通锌锰电池高 |
分析 锌锰碱性电池中,锌易失电子作负极,MnO2是正极,正极上MnO2得电子生成MnOOH,电解质溶液为氢氧化钾溶液,据此分析.
解答 解:A.锌锰碱性电池中,锌易失电子作负极,MnO2是正极,故A错误;
B.锌锰碱性电池中,电解质溶液为氢氧化钾溶液,故B正确;
C.锌失电子化合价升高,被氧化发生氧化反应,MnO2得电子化合价降低被还原,发生还原反应,故C正确;
D.在碱性条件下,锌与二氧化锰更稳定,所以放电比普通锌锰电池储存时间更久,故D正确.
故选A.
点评 本题考查了化学电源,题目难度不大,注意把握电池中正负极的判断,会根据氧化还原反应理论分析电极反应.

练习册系列答案
相关题目
2.下列叙述中不正确的是( )
| A. | 福尔马林可使蛋白质变性,故可浸制标本 | |
| B. | 海水提取溴、煤的液化、纯碱去油污都发生了化学变化 | |
| C. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 | |
| D. | Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质 |
3.下列关于有机物的说法,正确的是( )
| A. | 聚乙烯和乙烯性质相似,都能发生加成反应 | |
| B. | 纤维素、橡胶和光导纤维都属于有机高分子化合物 | |
| C. | 乙烯和乙醇都可发生加成反应 | |
| D. | 等量的CH4和Cl2在光照下反应不能生成纯净的CH3Cl |
20.下列说法中错误的是( )
| A. | 淀粉、纤维素和蛋白质均属于高分子化合物 | |
| B. | 用漂白粉漂白时,向水溶液中加几滴白醋,会增强漂白效果 | |
| C. | 利用乙醇的还原性以及Cr3+、Cr2O7-的颜色差异来检验酒后驾车 | |
| D. | 合成纤维和光导纤维都是新型无机非金属材料 |
7.制取下列有机物较理想的反应是( )
| A. | 乙烯催化加水制取工业酒精 | |
| B. | 酒精和浓硫酸混合后缓慢加热制取乙烯 | |
| C. | 甲烷和氯气在光照条件下制取氯仿 | |
| D. | 碱石灰和醋酸钠晶体制取甲烷 |
17.室温下,在一个无色透明恒容的密闭容器中存在如下平衡体系:2NO2 (红棕色,g)?N2O4 (无色,g)△H<0.现将该容器浸入冰水中,则正确现象是( )
| A. | 气体颜色变深 | B. | 气体颜色不变 | C. | 气体颜色变浅 | D. | 先变深后变浅 |
4.在密闭容器中进行反应:H2(g)+Br2(g)?2HBr(g)△H<0,达到平衡后,欲使颜色加深,应采取的措施是( )
| A. | 升高温度 | B. | 使用催化剂 | C. | 增大H2浓度 | D. | 减小压强 |
2.某研究性学习小组设计如图装置制取氯气并检验氯气的某些性质.
(1)制取Cl2,检验干燥氯气是否有漂白性.
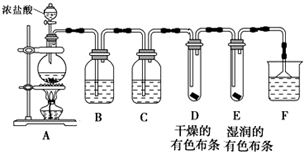
①盛装浓盐酸的仪器的名称是分液漏斗,烧瓶中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②B中盛有饱和食盐水,其作用是除去Cl2中混有的HCl,C中盛装的试剂是浓硫酸
③通入Cl2后,D、E中观察到的现象是中布条不褪色,E中布条褪色;根据现象可得出的结论是干燥的Cl2没有漂白性.
④F中盛有NaOH溶液,其作用是吸收氯气,防止环境污染,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为0.1mol.
(2)探究铁丝在Cl2中燃烧的产物
某同学认为,当足量Cl2与少量铁丝反应时生成FeCl3,当少量Cl2与足量铁丝反应时生成FeCl2.为检验该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物配制成溶液A、B,并取溶液进行以下实验,请填写下表中的空格.
④根据实验结论,铁丝在Cl2中点燃的化学方程式:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3 .
(1)制取Cl2,检验干燥氯气是否有漂白性.

①盛装浓盐酸的仪器的名称是分液漏斗,烧瓶中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②B中盛有饱和食盐水,其作用是除去Cl2中混有的HCl,C中盛装的试剂是浓硫酸
③通入Cl2后,D、E中观察到的现象是中布条不褪色,E中布条褪色;根据现象可得出的结论是干燥的Cl2没有漂白性.
④F中盛有NaOH溶液,其作用是吸收氯气,防止环境污染,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为0.1mol.
(2)探究铁丝在Cl2中燃烧的产物
某同学认为,当足量Cl2与少量铁丝反应时生成FeCl3,当少量Cl2与足量铁丝反应时生成FeCl2.为检验该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物配制成溶液A、B,并取溶液进行以下实验,请填写下表中的空格.
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中滴加2滴①KSCN溶液 | ②两份溶液都变血红色 | 生成物中都有FeCl3 |
| 分别向A、B溶液中滴加几滴KMnO4溶液 | 两份溶液颜色均无明显变化 | 生成物中都不含③FeCl2 |
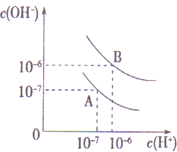 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: