题目内容
2.下列叙述中不正确的是( )| A. | 福尔马林可使蛋白质变性,故可浸制标本 | |
| B. | 海水提取溴、煤的液化、纯碱去油污都发生了化学变化 | |
| C. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 | |
| D. | Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质 |
分析 A.甲醛可使蛋白质变性;
B.海水提取溴是将Br-转化为Br2;煤炭液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料甲醇;碱性物质促进油脂水解,纯碱水解导致其水溶液呈碱性,从而促进油脂水解;
C.原电池中,电解质浓度越大,产生的电流强度越大;
D.Li属于第IA族元素,其密度较小,也较活泼.
解答 解:A.福尔马林的主要成分为甲醛,甲醛可使蛋白质变性,可用于浸制标本,故A正确;
B.海水提取溴是将Br-转化为Br2;煤炭液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料甲醇;
碱性物质促进油脂水解,纯碱水解导致其水溶液呈碱性,从而促进油脂水解,这几个变化都有新物质生成,所以都发生了化学变化,故B正确;
C.钢铁在海水中的腐蚀更容易是因为海水中有电解质,导致电流强度增大,腐蚀加快,故C错误;
D.Li属于第IA族元素,其密度较小,Li原子最外层有1个电子,所以易失电子,其金属活动性较强,是理想的电池原理,故D正确;
故选C.
点评 本题考查金属腐蚀与防护、化学变化及物理变化、蛋白质的性质等知识点,为高频考点,明确原电池原理、化学变化和物理变化的区别、物质的性质是解本题关键,注意化学变化和物理变化的根本区别,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4. 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol.
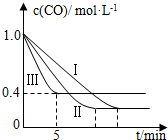
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1的影响,某活动小组设计了三个实验,实验曲线如图所示.
①请依据实验曲线图补充完整表格中的实验条件:X=530℃,Y=5MPa.
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、1mol CO2(g)、0.1mol H2(g),此时化学反应将向逆方向(填“向正方向”、“向逆方向”或“不”) 移动.
 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol.
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1的影响,某活动小组设计了三个实验,实验曲线如图所示.
| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、1mol CO2(g)、0.1mol H2(g),此时化学反应将向逆方向(填“向正方向”、“向逆方向”或“不”) 移动.
5.氯气是一种有毒气体,在运输和储存过程中必须防止泄露.若储存液氯的钢瓶发生泄露,立即采取的措施中错误的是( )
| A. | 将人群向低处疏散 | B. | 将人群逆风向疏散 | ||
| C. | 用浸有水的毛巾捂住口鼻 | D. | 向泄露地点撒一些石灰 |
9.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=13的溶液中:Fe3+、NH4+、NO3-.CO32- | |
| B. | c(OH-)=0.1mol•L-1的溶液中:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol•L-1的NaAlO2溶液中:Na+、Al3+、HCO3-、SO42- | |
| D. | pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
14.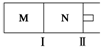 M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
 M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A. | 若x:y=1:2,则平衡时,M中的转化率:A>B | |
| B. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| C. | 若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.4mol A时,v正>v逆 | |
| D. | 起始时,分别向M、N两个容器中加入1molA和1molC,达到平衡时,容器M、N中物质A的体积分数:M<N |
12.下列对碱性锌锰电池的叙述不 正确的是( )
| A. | 锌是正极,MnO2是负极 | |
| B. | 电解质是KOH溶液 | |
| C. | 锌发生氧化反应,MnO2发生还原反应 | |
| D. | 它的能量和储存时间比普通锌锰电池高 |