题目内容
7.制取下列有机物较理想的反应是( )| A. | 乙烯催化加水制取工业酒精 | |
| B. | 酒精和浓硫酸混合后缓慢加热制取乙烯 | |
| C. | 甲烷和氯气在光照条件下制取氯仿 | |
| D. | 碱石灰和醋酸钠晶体制取甲烷 |
分析 A.乙烯与水发生加成反应生成乙醇;
B.酒精和浓硫酸迅速加热至170℃发生消去反应生成乙烯;
C.甲烷和氯气在光照条件下发生取代反应,为链锁反应,产物复杂;
D.实验室中可用无水醋酸钠和碱石灰共热制备甲烷气体.
解答 解:A.乙烯与水发生加成反应生成乙醇,则乙烯催化加水制取工业酒精,故A正确;
B.酒精和浓硫酸迅速加热至170℃发生消去反应生成乙烯,缓慢加热可能生成乙醚,故B错误;
C.甲烷和氯气在光照条件下发生取代反应,为链锁反应,产物复杂,不能利用光照条件下制取氯仿,故C错误;
D.实验室制甲烷时不能用醋酸钠晶体,而必须用无水醋酸钠,因为有水存在时,CH3COONa和NaOH都是离子化合物发生电离,不能使CH3COONa中C-C和NaOH中O-H键的断裂,因而不能制得甲烷,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应等为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=13的溶液中:Fe3+、NH4+、NO3-.CO32- | |
| B. | c(OH-)=0.1mol•L-1的溶液中:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol•L-1的NaAlO2溶液中:Na+、Al3+、HCO3-、SO42- | |
| D. | pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
18.下列说法正确的是( )
| A. | 糖类、油脂、蛋白质在人体内发生氧化反应最终均只得到CO2和H2O | |
| B. | 蛋白质溶液中混有少量的NaCl,可加硝酸银溶液后过滤除去杂质 | |
| C. | 在食品包装袋内放入小包装的生石灰和铁粉可以防止食品受潮和变质 | |
| D. | 装修材料如化纤地毯、三合板、大理石等均会释放出污染空气的甲醛气体 |
15.以石墨电极电解200mL CuSO4溶液,电解过程中转移电子的物质的量n(e-)与产生气体体积V(g)(标准状况)的关系如图所示.下列说法中,正确的是( )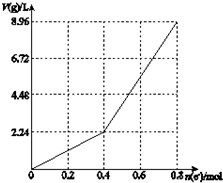

| A. | 电解前CuSO4溶液的物质的量浓度为2 mol/L | |
| B. | 电解后所得溶液中c(H+)=2 mol/L | |
| C. | 当n(e-)=0.6 mol时,V(H2):V(O2)=3:2 | |
| D. | 向电解后的溶液中先后加入16 g CuO和3.6g水,则溶液可恢复为电解前的浓度 |
2.实验室配制100mL 1.00mol/L NaCl溶液时,下列操作正确的是( )
| A. | 用托盘天平称取5.85g NaCl固体 | |
| B. | 将称出的固体在容量瓶中充分溶解 | |
| C. | 将烧杯紧靠容量瓶的瓶口转移溶液 | |
| D. | 当液面距离量瓶瓶颈的刻度线下1~2cm时,改用胶头滴管定容 |
12.下列对碱性锌锰电池的叙述不 正确的是( )
| A. | 锌是正极,MnO2是负极 | |
| B. | 电解质是KOH溶液 | |
| C. | 锌发生氧化反应,MnO2发生还原反应 | |
| D. | 它的能量和储存时间比普通锌锰电池高 |
16.如图所示,甲池的总反应式为 2CH3OH+3O2+4KOH═2K2CO3+6H2O.下列说法正确的 是( )
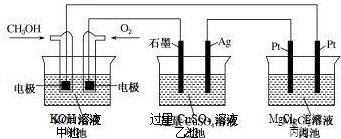

| A. | 若将乙池电解液换成 AgNO3 溶液,则可以实现在石墨棒上镀银 | |
| B. | 甲池通入 CH3OH 的电极反应式为 CH3OH+6e-+2H2O═CO32-+8H+ | |
| C. | 反应一段时间后,向乙池中加入一定量 Cu(OH)2 固体,能使 CuSO4溶液恢复到 原浓度 | |
| D. | 甲池中消耗 224mL(标准状况下)O2,此时丙池中理论上产生 1.16g 固体 |
17.下列物质属于电解质的是( )
| A. | Na2SO4 | B. | CO2 | C. | Cl2 | D. | Cu |