题目内容
9.下列物质不含官能团的是①(CH3)3C-CH3 ②CH2=CH2 ③CH≡CH ④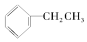 ⑤CH3COOCH3 ⑥
⑤CH3COOCH3 ⑥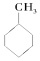
| A. | ②③⑤ | B. | ①⑤⑥ | C. | ①④⑥ | D. | ①④⑤ |
分析 常见的官能团有:碳碳双键、三键、-OH、-CHO、-COOH、-COOC-、-CONH-及醚键等,以此来解答.
解答 解:①④⑥中不含官能团,②中官能团为碳碳双键,③中官能团为碳碳三键,⑤中官能团为-COOC-,
故选C.
点评 本题考查有机物的官能团,为高频考点,把握有机物的结构、官能团为解答的关键,侧重分析与应用能力的考查,注意烃基、苯基不是官能团,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
19.化学是以实验为基础的学科,化学实验设计和操作中必须十分重视安全问题和环境保护问题.下列操作不是围绕上述问题的是( )
| A. | 用氯酸钾和二氧化锰制氧气时用排水法收集后,应从水中撤出导管后再停业加热 | |
| B. | 在氢气还原氧化铜停止加热后,还要继续通一会儿氢气 | |
| C. | 实验室制备CO气体必须在通风橱中进行 | |
| D. | 蒸馏操作时应在混合液中加入沸石 |
20.下列说法错误的是( )
| A. | NaClO溶液中:c(Na+)=c(ClO-)+c(OH-)+c(HClO) | |
| B. | 常温下,pH=a的NH4Cl溶液中由水电离产生的c(OH-)=10-amol•L-1 | |
| C. | 向0.1 mol•L-1的Na2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| D. | Na2S稀溶液中:c(OH-)=c(H+)+2c(H2S)+c(HS-) |
17.质量分数为35%,密度为1.24/cm3的硫酸物质的量浓度为( )
| A. | 0.044mol/L | B. | 0.44mol/L | C. | 4.4mol/L | D. | 44mol/L |
4.有可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2,下列叙述正确的是( )
| A. | 该反应达到平衡状态时c(CO2)=c(CO) | |
| B. | 该反应的正反应是放热反应 | |
| C. | 若起始时把Fe和2.0mol CO2放入体积固定为1 L的密闭容器中,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=1.0 | |
| D. | 若该反应在体积固定的密闭容器中进行,在恒温下达到平衡状态,再通入CO反应混合气体中CO2的物质的量分数增大 |
14.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)?2Z(g)△H<0.一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正) | |
| C. | 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,c(Z)=0.24 mol•L-1 | |
| D. | 该温度下此反应的平衡常数:K=1.44 |
18.下列说法正确的是( )
| A. | 发生化学键断裂的变化一定是化学变化 | |
| B. | 一定条件下某化学反应不论一步完成还是多步完成,△H一定相同 | |
| C. | 化学反应的△H一定与反应热相同 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
19.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 0.1 mol Na2O2与足量CO2反应转移的电子数目为0.2NA | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 标准状况下,22.4LSO3中含有的分子数为NA. | |
| D. | 18g重水(2H216O)含有的电子数为10NA |