题目内容
19.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 0.1 mol Na2O2与足量CO2反应转移的电子数目为0.2NA | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 标准状况下,22.4LSO3中含有的分子数为NA. | |
| D. | 18g重水(2H216O)含有的电子数为10NA |
分析 A.0.1mol过氧化钠与二氧化碳完全反应生成0.05mol氧气,结合过氧化钠中氧元素的化合价为-1价分析;
B.NO2和N2O4的最简式为NO2,根据最简式计算混合物中含有的原子数;
C.标况下三氧化硫的状态不是气态;
D.2H216O的摩尔质量为20g/mol,2H216O分子中含有10电子.
解答 解:A.0.1 mol Na2O2与足量CO2反应生成0.05mol氧气,转移电子的物质的量为:0.05mol×2=0.1mol,转移的电子数目为0.1NA,故A错误;
B.46gNO2和N2O4混合气体中含有46g最简式NO2,含有最简式的物质的量为:$\frac{46g}{46g/mol}$=1mol,1mol最简式NO2中含有3mol原子,含有原子总数为3NA,故B正确;
C.标准状况下,三氧化硫不是气体,不能使用气体摩尔体积计算,故C错误;
D.18g重水(2H216O)的物质的量为:$\frac{18g}{20g/mol}$=$\frac{9}{10}$mol,含有电子的物质的量为$\frac{9}{10}$mol×10=9mol,则含有的电子数为9NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标准状况下气体摩尔体积的使用条件.

练习册系列答案
相关题目
9.下列物质不含官能团的是①(CH3)3C-CH3 ②CH2=CH2 ③CH≡CH ④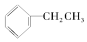 ⑤CH3COOCH3 ⑥
⑤CH3COOCH3 ⑥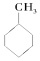
 ⑤CH3COOCH3 ⑥
⑤CH3COOCH3 ⑥
| A. | ②③⑤ | B. | ①⑤⑥ | C. | ①④⑥ | D. | ①④⑤ |
10.已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-,Br-,CrO4-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
| A. | I-、Br-、CrO4- | B. | Br-、Cl-、CrO4- | C. | CrO4-、Br-、I- | D. | Br-、CrO4-、Cl- |
7.下列装置所示的实验中,能达到实验目的是( )
| A. | 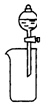 从Mg(OH)2悬浊液中分离出Mg(OH)2 | B. | 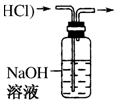 除去HCl中的SO2 | ||
| C. | 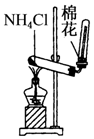 实验室制氨气 | D. | 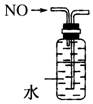 排水法收集NO |
11.设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
| A. | 常温常压下,8gCH4中含有的氢原子数为2NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为22.4L | |
| C. | 常温常压下,48氧气和臭氧(O3)混合物中所含氧原子总数为3NA | |
| D. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,含有Cl-个数为1NA |
8.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3KJ/mol,则40gNaOH固体与稀盐酸完全反应,放出的热量即为57.3KJ | |
| B. | 已知C(s)+O2(g)=CO2(g)△H1 C(s)+$\frac{1}{2}{O_2}$(g)=CO(g)△H2 则△H1<△H2 | |
| C. | 已知H2(g)+Cl2(g)=2HCl,△H=-184.6KJ/mol,则反应物总能量小于生成物总能量 | |
| D. | 已知P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定 |
9.下列反应中,水作还原剂的是( )
| A. | C+H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2 | B. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | ||
| C. | Cl2+H2O?HCl+HC1O | D. | 2F2+2H2O=4HF+O2 |
