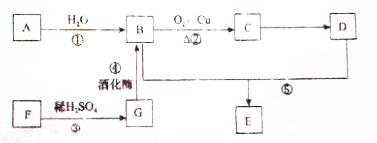
题目内容
14.在体积为VL的密闭容器中通入4mol CO和5mol O2,点燃充分反应后,容器内碳原子数和氧原子数之比为( )| A. | 4:5 | B. | 2:7 | C. | 2:5 | D. | 2:9 |
分析 在一定条件下充分反应后,根据质量守恒定律,则可知碳原子和氧原子的个数不变,据此解答.
解答 解:根据质量守恒定律,反应后碳原子、氧原子数目不变,则n(C)=4mol、n(O)=4mol+10mol=14mol,
故容器内碳原子数和氧原子数之比为4mol:14mol=2:7,
故选B.
点评 本题考查质量守恒定律定律,比较基础,注意理解质量守恒定律的宏观与微观意义.

练习册系列答案
相关题目
4.下列表示不正确的是( )
| A. | CO2的电子式: | B. | 乙炔的结构式:H-C≡C-H | ||
| C. | CH4的比例模型: | D. | Cl-的结构示意图: |
5.对下列化学用语中“2”所表示意义的理解,错误的是( )
| A. | Fe2+中的“2”表示一个亚铁离子带两个单位正电荷 | |
| B. | 2CO中的“2”表示两个一氧化碳分子 | |
| C. | MgCO3-2中的“2”表示碳酸根的化合价为-2价 | |
| D. | 2O中的“2”表示两个氧元素 |
2.下列与实验相关的叙述正确的是( )

| A. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| B. | 将25 g CuSO4•5H2O溶于100 mL蒸馏水配制100 mL 1.0 mol•L-1 CuSO4溶液 | |
| C. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| D. | 配制100 mL 0.100 0 mol•L-1 K2Cr2O7溶液所选择的装置或仪器(夹持装置已略去)是 |
5.现有四种短周期元素的原子半径及主要化合价数据如表所示:
下列叙述不正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子半径/nm | 0.186 | 0.102 | 0.152 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
| A. | 甲的最高价氧化物对应水化物的碱性比丙的强 | |
| B. | 甲单质可用电解其盐溶液的方法冶炼而得 | |
| C. | 常温下,丁的两种氢化物均为液体 | |
| D. | 乙的简单离子是四种元素各自形成的简单离子中半径最大的 |
12.在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀.下列叙述不正确的是( )
| A. | 沉淀转化的实质就是沉淀溶解平衡的移动 | |
| B. | 溶解度小的沉淀可以转化成溶解度更小的沉淀 | |
| C. | 25℃时,在饱和AgCl、AgI、Ag2S溶液中所含c(Ag+)不同 | |
| D. | AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同 |
9.下列各种醇不能被氧化成醛或酮的是(提示:酮的结构为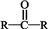 )( )
)( )
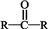 )( )
)( )| A. | CH3OH | B. | 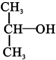 | C. | 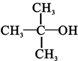 | D. | 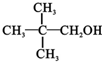 |
10.下列各步制取物质,最终无法达到目的有( )
| A. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{蒸发、结晶}{→}$CuSO4•5H2O | |
| B. | Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{过量氨水}{→}$Fe(OH)3$\stackrel{灼烧}{→}$Fe2O3 | |
| C. | NaOH溶液$\stackrel{SO_{2}}{→}$Na2SO3$\stackrel{SO_{2}}{→}$NaHSO3$→_{灼烧}^{蒸干}$Na2SO4 | |
| D. | Al$→_{△}^{O_{2}}$Al2O3$\stackrel{HCl}{→}$AlCl3溶液$→_{△}^{蒸干}$AlCl3晶体 |