题目内容
5.现有四种短周期元素的原子半径及主要化合价数据如表所示:| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子半径/nm | 0.186 | 0.102 | 0.152 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
| A. | 甲的最高价氧化物对应水化物的碱性比丙的强 | |
| B. | 甲单质可用电解其盐溶液的方法冶炼而得 | |
| C. | 常温下,丁的两种氢化物均为液体 | |
| D. | 乙的简单离子是四种元素各自形成的简单离子中半径最大的 |
分析 由短周期元素的原子半径及主要化合价,则乙、丁同主族,丁只有-2价,则为O,所以乙为S;甲、丙均为ⅠA族元素,结合原子半径,则甲为Na,丙为Li;
A.第ⅠA族从上到下最高价氧化物对应水化物的碱性减弱;
B.电解熔融NaCl来冶炼钠;
C.氧元素的两种氢化物为水和过氧化氢;
D.电子层数越多,离子半径越大.
解答 解:由短周期元素的原子半径及主要化合价,则乙、丁同主族,丁只有-2价,则为O,所以乙为S;甲、丙均为ⅠA族元素,结合原子半径,则甲为Na,丙为Li;
A.甲为Na,丙为Li,则第ⅠA族从上到下最高价氧化物对应水化物的碱性减弱,即甲的最高价氧化物对应水化物的碱性比丙的强,故A正确;
B.Na的化学性质很活泼,则利用电解熔融NaCl来冶炼钠,不能用电解其盐溶液的方法冶炼而得,故B错误;
C.氧元素的两种氢化物为水和过氧化氢,常温下均为液体,故C正确;
D.电子层数越多,离子半径越大,只有硫离子的电子层数最多,所以乙的简单离子是四种元素各自形成的简单离子中半径最大的,故D正确;
故选B.
点评 本题考查位置、结构、性质的关系及应用,明确短周期元素的化合价及半径来推断元素是解答本题的关键,熟悉元素周期律及金属冶炼即可解答,题目难度中等.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
9.下列离子方程式不正确的是( )
| A. | 硫化亚铁和稀盐酸反应:FeS+2H+=Fe2++H2S↑ | |
| B. | 次氯酸钠溶液中通入少量SO2反应:SO2+H2O+ClO-=SO42-+Cl-+2H+ | |
| C. | 过氧化钠加入足量稀硫酸反应:2Na2O2+4H+═4Na++O2↑+2H2O | |
| D. | 铜粉中加入溴化铁溶液反应:2Fe3++Cu=2Fe2++Cu2+ |
10.推理是化学学习中常用的思维方法.下列推理中正确的是( )
| A. | 单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质 | |
| B. | 氧元素与硫元素原子的最外层电子数相同,所以二者具有相似的化学性质 | |
| C. | 溶液中有晶体析出,其溶质质量减小,所以溶质的质量分数一定减小 | |
| D. | 碱溶液能使酚酞试液变红,滴入酚酞试液后变红的一定是碱溶液 |
14.在体积为VL的密闭容器中通入4mol CO和5mol O2,点燃充分反应后,容器内碳原子数和氧原子数之比为( )
| A. | 4:5 | B. | 2:7 | C. | 2:5 | D. | 2:9 |
10.下列关于沉淀溶解的说法正确的是( )
| A. | 只有难溶电解质才存在沉淀溶解平衡过程 | |
| B. | 沉淀溶解平衡过程是可逆的 | |
| C. | 在平衡状态时v溶解=v结晶=0 | |
| D. | 达到沉淀溶解平衡的溶液一定是饱和溶液 |
14.下列各组元素中,按最高正化合价递减的顺序排列的是( )
| A. | C、N、O | B. | S、P、Si | C. | F、O、Br | D. | H、Ca、Al |
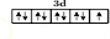 ;
;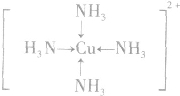 ;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;
;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;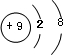 ,该元素与金属性最强的元素形成的化合物的电子式为
,该元素与金属性最强的元素形成的化合物的电子式为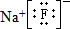 ;该化合物中存在的化学键为离子键 (选填“离子键”或“共价键”).
;该化合物中存在的化学键为离子键 (选填“离子键”或“共价键”).