题目内容
10.下列各步制取物质,最终无法达到目的有( )| A. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{蒸发、结晶}{→}$CuSO4•5H2O | |
| B. | Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{过量氨水}{→}$Fe(OH)3$\stackrel{灼烧}{→}$Fe2O3 | |
| C. | NaOH溶液$\stackrel{SO_{2}}{→}$Na2SO3$\stackrel{SO_{2}}{→}$NaHSO3$→_{灼烧}^{蒸干}$Na2SO4 | |
| D. | Al$→_{△}^{O_{2}}$Al2O3$\stackrel{HCl}{→}$AlCl3溶液$→_{△}^{蒸干}$AlCl3晶体 |
分析 A.铜与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜,结晶得到CuSO4•5H2O;
B.铁与氯气反应生成氯化铁,氯化铁和一水合氨发生复分解反应生成氢氧化铁,灼烧氢氧化铁得到三氧化二铁;
C.二氧化硫与氢氧化钠反应生成亚硫酸钠,过量的二氧化硫反应生成亚硫酸氢钠,亚硫酸氢钠受热分解生成亚硫酸钠,亚硫酸钠被氧气氧化为硫酸钠;
D.Al3+水解平衡右移,最后蒸干灼烧得到Al2O3.
解答 解:A.铜与氧气反应2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO生成氧化铜,氧化铜与硫酸反应CuO+H2SO4(稀)=CuSO4+H2O,生成硫酸铜,结晶得到CuSO4•5H2O,可以达到目的,故A正确;
B.氯气能将金属氧化为最高价,铁在氯气中燃烧的产物是氯化铁,反应为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,生成氯化铁,氯化铁和一水合氨发生复分解反应FeCl3+3NH3•H2O=Fe(0H)3↓+3NH4Cl,生成氢氧化铁,灼烧氢氧化铁得到三氧化二铁,可以达到目的,故B正确;
C.二氧化硫与氢氧化钠反应SO2+2NaOH=Na2SO3+H2O生成亚硫酸钠,过量的二氧化硫反应生成亚硫酸氢钠SO2+NaOH=NaHSO3,亚硫酸氢钠受热分解2NaHSO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO3+H2O+SO2↑生成亚硫酸钠,亚硫酸钠被氧气氧化2Na2SO3+O2=2Na2SO4生成硫酸钠,可以达到目的,故C正确;
D.AlCl3溶液溶液中,Al3+水解A13++3H2O?Al(OH)3+3H+,由于HCl挥发,平衡右移,最后蒸干灼烧得到Al2O3,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,侧重物质的转化,注意把握反应的原理,题目难度不大.

| A. | 4:5 | B. | 2:7 | C. | 2:5 | D. | 2:9 |
| A. | He | B. | C | C. | Al | D. | Si |
| A. | CH3CHClCH2CH3 2-氯丁烷 | B. | CH3COOC2H5 乙酸乙酯 | ||
| C. | CH3CH2CH (CH3)2 2-甲基丁烷 | D. | 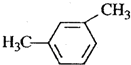 2,5-二甲苯 2,5-二甲苯 |

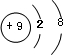 ,该元素与金属性最强的元素形成的化合物的电子式为
,该元素与金属性最强的元素形成的化合物的电子式为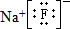 ;该化合物中存在的化学键为离子键 (选填“离子键”或“共价键”).
;该化合物中存在的化学键为离子键 (选填“离子键”或“共价键”).