题目内容
20.下列电离方程式错误的是( )| A. | NaHCO3=Na++H++CO32- | B. | NaHSO4=Na++H++SO42- | ||
| C. | H2SO4=2H++SO42- | D. | CH3COOH?CH3COO-+H+ |
分析 A.碳酸氢钠为强电解质,完全电离,注意碳酸氢根离子为弱酸的酸式根离子不能拆;
B.硫酸氢钠是强电解质,能完全电离出Na+和H+、SO42-,溶液有强的酸性;
C.硫酸为强电解质,一步完全电离出氢离子与硫酸根离子;
D.CH3COOH为弱电解质,部分电离,用可逆符号.
解答 解:A.碳酸氢根离子为弱酸的酸式根离子不能拆,碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-,故A错误;
B.NaHSO4在溶液中电离生成Na+和H+、SO42-,电离方程式为:NaHSO4=Na++H++SO42-,故B正确;
C.硫酸为强电解质,完全电离出氢离子与硫酸根离子,电离方程式:H2SO4=2H++SO42-,故C正确;
D.乙酸为弱电解质,部分电离,电离方程式:CH3COOH?CH3COO-+H+,故D正确;
故选A.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意原子团不能拆,注意电离方程式遵循原子个数、电荷数守恒规律,注意多元强酸一步电离,多元弱酸分步电离,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
11.在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )

| A. | 碳棒上有气体放出,溶液pH变小 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,外电路中,电流从a极到b极 | |
| D. | a极上发生了氧化反应 |
15.如图所示的实验操作不正确的是( )
| A. |  铁丝在氧气中燃烧 | B. |  读取液体的体积 | ||
| C. |  除去CO中的CO2 | D. |  制取蒸馏水 |
5.在25℃时,体积一定的密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是
( )
( )
| 物质 | X | Y | Z |
| 初始浓度(mol•L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 反应可表示为X+3Y?2Z,其平衡常数为1600 | |
| B. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| C. | 反应达到平衡时,X的转化率为50% | |
| D. | 反应起始时和达平衡时的压强比为3:2 |
9.下列电离方程式书写不正确的是( )
| A. | CaCl2═Ca2++2Cl- | B. | NH3•H2O?NH4++OH- | ||
| C. | CH3COOH═CH3COO-+H+ | D. | H2SO4═2H++SO42- |
10.下列说法正确的是( )
| A. | 需要加热的反应一定是吸热反应 | |
| B. | 不需要加热的反应一定是放热反应 | |
| C. | 停止加热,反应就停止,该反应一定是吸热反应 | |
| D. | 放热反应都会发光并产生火焰 |
 .
.
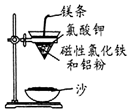 铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.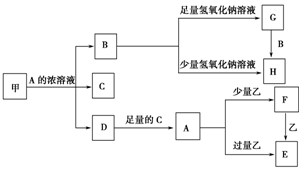 中学化学中常见的几种物质存在如图关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体.(图中部分产物和反应条件已略去)
中学化学中常见的几种物质存在如图关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体.(图中部分产物和反应条件已略去)