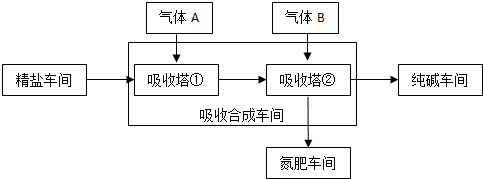
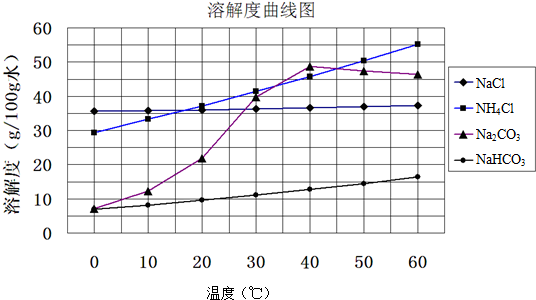
题目内容
16.18.6g Na2R含Na+0.6mol,则含R-0.3 mol;则Na2R的摩尔质量为62g/mol,R的相对原子质量为16.含R的质量为1.6g的Na2R,其物质的量为0.1mol,Na+个数为0.2NA(用NA表示).分析 依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算解答.
解答 解:Na2R为强电解质,完全电离1molNa2R电离生成2mol钠离子和1molR-,所以Na2R含Na+0.6mol,则Na2R物质的量为0.3mol,含R- 0.3 mol;$\frac{18.6g}{0.3mol}$=62g/mol;R-摩尔质量为:62-2×23=16(g/mol),R的相对原子质量为16;R的质量为1.6g的Na2R,含有R物质的量为:$\frac{1.6g}{16g/mol}$=0.1mol,则含R的质量为1.6g的Na2R,其物质的量为 0.1mol,含有钠离子的物质的量为0.2mol,Na+个数为用0.2NA;
故答案为:0.3; 62g/mol;16;0.1mol; 0.2NA.
点评 本题考查了阿伏伽德罗常数的有关计算和公式的运用,难度不大,掌握好以物质的量为核心的相关计算公式是解题关键,题目难度不大.

练习册系列答案
相关题目
6.T K时,向2L恒容密闭容器中充入1molCOCl2,发生反应COCl2(g)?Cl2(g)+CO(g),经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
下列说法正确的是( )
| t/% | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前2s的平均速率v(CO)=0.080mol/L/s | |
| B. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.11mol/L | |
| C. | T K时起始向容器中充入0.9molCOCl2/0.10molCO,反应达到平衡前v(正)>v(逆) | |
| D. | T K时起始向容器中充入1.0molCl2和0.9molCO.达到平衡时,Cl2的转化率小于80% |
7.(1)判断下过程的△H、△S大于零还是小零,用“>0”或“<0”填写下列表格
(2)化学反应A(g)+B(g)?C(g)+D(g)△H<0,850℃时,K=l t℃时,在一定体积的容器中,通入一定量的A和B,发生反应,各物质浓度随时间变化如下表:t℃时物质的浓度(mol•L-1)变化
①t℃大于850℃(填大于、小于或等于).
②反应在4min~5min之间,平衡向左(填“向左”、“向右”或“不”)移动,可能的原因是C
a.使用催化剂 b.增加C的浓度 c.增加D的浓度 d.增加A的浓度.
| 变化过程 | △H | △S |
| 4Fe(s)+3O2(g)=2Fe2O3(s) | <0 | |
| CaCO3(s)分解为CaO(s)和CO2(g) |
| 时间/min | A | B | C | D |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 |
②反应在4min~5min之间,平衡向左(填“向左”、“向右”或“不”)移动,可能的原因是C
a.使用催化剂 b.增加C的浓度 c.增加D的浓度 d.增加A的浓度.
4.V L Al2(SO4)3溶液中含有Al3+m g,则溶液中SO42-的物质的量浓度为( )
| A. | $\frac{27m}{v}$mol/L | B. | $\frac{m}{9v}$mol/L | C. | $\frac{m}{27v}$mol/L | D. | $\frac{m}{18v}$mol/L |
11.现有①MgSO4,②Ba(NO3)2,③NaOH,④CuCl2,⑤KCl五种溶液,不加任何其他试剂,可鉴别且鉴别的先后顺序也正确的是( )
| A. | ④③②①⑤ | B. | ④⑤③②① | C. | ④③①②⑤ | D. | ④②③①⑤ |
8.下列叙述正确的是( )
| A. | NaCl的摩尔质量是58.5g | |
| B. | 32g氧气中含有2mol氧 | |
| C. | 58.5gNaCl中含有l mol NaCl分子 | |
| D. | 0.l mol二氧化碳含有6.02×1022个CO2分子 |