题目内容
1.某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、SO42-,现每次取该溶液100.00ml溶液进行以下实验:①第一份加入AgNO3溶液发现有沉淀生成;
②第二份加足量BaCl2溶液生成沉淀,洗涤后干燥得沉淀6.27g,再将该沉淀加入足量盐酸溶解后再过滤洗涤干燥得沉淀2.33g..
请回答下列问题:
(1)根据以上实验判断,原溶液中可能存在的离子是Cl-.
(2)原溶液中一定存在的阳离子是K+,其物质的量浓度至少为0.6mol/l.
(3)原溶液中一定存在的阴离子是CO32-、SO42-,
(4)第二步操作中沉淀部分溶解的离子反应方程式BaCO3+2H+=Ba2++H2O+CO2↑.
分析 ①第一份加入AgNO3溶液发现有沉淀生成,该溶液中可能含有Cl-、CO32-、SO42-;
②第二份加足量BaCl2溶液生成沉淀,洗涤后干燥得沉淀6.27g,再将该沉淀加入足量盐酸溶解后再过滤洗涤干燥得沉淀2.33g,沉淀减少,部分溶解,说明该溶液中含一定含有CO32-和SO42-离子,则一定不含Ca2+、Fe2+、Cu2+,依据溶液电中性原则,判断一定含有K+,据此解答各小题.
解答 解:①第一份加入AgNO3溶液发现有沉淀生成:该溶液中可能含有Cl-、CO32-、SO42-;
②第二份加足量BaCl2溶液生成沉淀,洗涤后干燥得沉淀6.27g,再将该沉淀加入足量盐酸溶解后再过滤洗涤干燥得沉淀2.33g,沉淀减少,部分溶解,2.33g白色沉淀为硫酸钡,物质的量为:$\frac{2.33g}{233g/mol}$=0.01mol;溶解的沉淀为只能为碳酸钡,其物质的量为:$\frac{6.72g-2.33g}{197g/mol}$=0.02mol,则该溶液中含一定含有CO32-和SO42-离子,根据离子共存可知一定不含Ca2+、Fe2+、Cu2+;
溶液一定为电中性的,则原溶液中一定含有K+.
(1)根据分析可知,原溶液中一定不存在的离子是Ca2+、Fe2+、Cu2+,可能存在的离子是Cl-,故答案为:Cl-;
(2)根据溶液呈电中性,钾离子的物质的量至少为:0.02mol×2+0.01mol×2=0.06mol,钾离子的浓度至少为:$\frac{0.06mol}{0.1L}$=0.6mol/L,故答案为:K+;0.6;
(3)根据分析可知,原溶液中一定存在0.01molSO42-、0.02molCO32-,故答案为:CO32-、SO42-;
(4)第二部操作中碳酸钡沉淀会溶于盐酸,反应离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑,故答案为:BaCO3+2H+=Ba2++H2O+CO2↑.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意掌握常见离子的检验方法,试题侧重考查学生的分析能力及逻辑推理能力,根据溶液电中性判断钾离子的存在情况为易错点.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应II:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
②下列说法不正确的是C
A.反应I:单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.反应I:若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.反应II:增大压强能使反应速率加快,是因为增加了活化分子百分数
D.恒温恒容条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体达到平衡,NO2体积分数变大.
| A. | 氧化物、化合物 | B. | 化合物、混合物 | C. | 溶液、胶体 | D. | 分散系、胶体 |
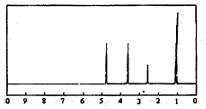
| A. | A分子属于酯类化合物 | |
| B. | A在一定条件下可与H2发生加成反应 | |
| C. | 符合题中A分子结构特征的有机物只有一种 | |
| D. | 与A属于同类化合物的同分异构体只有2种 |