题目内容
13.在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了0.1mol,则反应速率为( )| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.17 mol/(L•min) | D. | v(NH3)=0.01 mol/(L•min) |
分析 先根据氨气增加的物质的量和物质的量浓度公式计算其物质的量浓度,反应速率v=$\frac{△c}{△t}$计算得到氨气表示的反应速率,根据同一反应中各物质的反应速率之比等于其计量数之比计算氢气、氮气的速率.
解答 解:在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了0.1mol,氨气表示的反应速率v(NH3)=$\frac{\frac{0.1mol}{2L}}{5min}$=0.01mol/(L•min)
A.v(H2)=$\frac{3}{2}$v(NH3)=$\frac{3}{2}$×0.01mol/(L•min)=0.015mol/(L•min),故A错误;
B.v(N2)=$\frac{1}{2}$v(NH3)=0.005 mol/(L•min),故B错误;
C.v(NH3)=0.01mol/(L•min),故C错误;
D.v(NH3)=0.01mol/(L•min),故D正确;
故选D.
点评 本题考查的是反应速率的定量表示方法,根据同一反应中各物质的反应速率之比等于其计量数之比是解本题的关键,题目难度不大.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
3.下列各组元素性质递变情况错误的是( )
| A. | Li、Be、B原子最外层电子数依次升高 | |
| B. | P、S、Cl元素最高正化合价依次升高 | |
| C. | B、C、N、O、F原 子半径依次升高 | |
| D. | Li、Na、K的原子半径依次增大 |
1.下列有关化学用语使用正确的是( )
| A. | 符号为${\;}_8^{18}O$的原子常用于文物年代的测定 | |
| B. | CO2分子比例模型: | |
| C. | H2O2的电子式: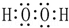 | |
| D. | 结构简式为CH2CH2的分子可发生加成反应 |
8.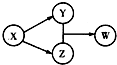 X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是( )
X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是( )
 X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是( )
X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是( )| A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | Al |
| Y | FeCl2 | NaOH | CO2 | Na[Al(OH)4] |
| Z | Cl2 | Na2CO3 | CaCO3 | AlCl3 |
| W | FeCl3 | NaHCO3 | Ca(HCO3)2 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
2.一定温度下,将2mol SO2 和1mol O2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,当达到平衡状态时,下列说法中正确的是( )
| A. | 反应放出197 kJ 的热量 | |
| B. | 生成SO3为2 mol | |
| C. | SO2和SO3物质的量之和为2 mol | |
| D. | SO2的物质的量和SO3物质的量一定相等 |

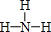 .②的简单气态氢化物的电子式为
.②的简单气态氢化物的电子式为 .
. X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍.
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍. .
.