题目内容
1.人体健康与食品、药物等关系密切.①青霉素是最重要的抗生素,用得较多的是青霉素G的钠盐,俗名B.
A.阿司匹林 B.盘尼西林 C.麻黄碱
②为了防止“过敏反应”的发生,在使用青霉素前需要B:
A.静脉滴注NaHCO3溶液 B.进行皮肤敏感试验 C.服用镇静催眠药
③青霉素属于R处方药(填“R处方药”或“OTC非处方药”)
分析 ①用的最多的是青霉素G的钠盐,即为盘尼西林;
②青霉素容易发生过敏反应;
③处方药是必须凭执业医师或执助理医师才可调配、购买和使用的药品.
解答 解:①青霉素是最重要的抗生素,用得较多的是青霉素G的钠盐,俗名盘尼西林;
故选:B;
②青霉素容易发生过敏反应,在使用青霉素前需要进行皮肤敏感试验;
故选:B;
③青霉素是必须凭执业医师或执助理医师才可调配、购买和使用的药品,属于R处方药;
故答案为:R处方药.
点评 本题考查药物及其疗效,题目注重化学与生活的联系,明确化学服务于生活,学会利用化学知识解决生活中的问题,难度不大.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
11.将0.20mol•L-1的NH3•H2O溶液和0.10mol•L-1的HCl溶液等体积混合,充分反应后,下列有关该溶液中各粒子浓度的关系不正确的是( )
| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(Cl-)+c(OH-) | ||
| C. | c(NH4+)+c(NH3•H2O)=0.10mol•L-1 | D. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
12.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
| A. | NaHSO4 和 Ba(OH)2 | B. | NaAlO2和HCl | C. | Na2CO3和 HCl | D. | AlCl3和 NaOH |
9.下列操作中不属于萃取的是( )
| A. | 从青蒿中提取青蒿素 | B. | 从溴水中提取溴单质 | ||
| C. | 浸泡药酒 | D. | 海水淡化 |
16.某一不饱和酯类化合物(如图)在药物、涂料等领域应用广泛,下列有关说法不正确的是( )


| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 1 mol该化合物和足量的钠反应生成1 mol H2 | |
| C. | 能与溴发生取代反应和加成反应 | |
| D. | 1 mol该化合物最多与2 mol NaOH反应 |
6.下列实验可行的是( )
| A. | 用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质 | |
| B. | 用乙醇从碘水中萃取碘 | |
| C. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| D. | 用食醋浸泡有水垢的水壶清除其中的水垢 |
10.把500mL有BaCl2和KC1的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A. | 0.1(b-2a)mol•L-1 | B. | 10(2a-b)mol•L-1 | C. | 10(b-a)mol•L-1 | D. | 10(b-2a)mol•L -1 |
11.某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
实验一 制取氯酸钾和氯水
利用如图1所示的实验装置进行实验.
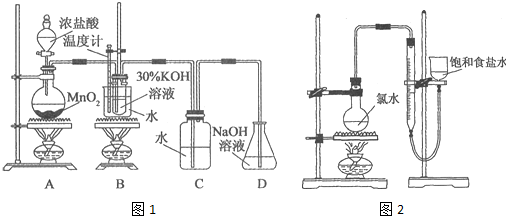
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有烧杯、漏斗、玻璃棒、胶头滴管.
(2)若对调B和C装置的位置,能(填“能”或“不能”)提高B中氯酸钾的产率.
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录如下(实验在室温下进行):
①系列a实验的实验目的是研究反应体系中硫酸浓度对反应产物的影响.
②设计1号试管实验的作用是硫酸浓度为0的对照实验.
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为ClO3-+6I-+6H+=Cl-+3I2+3H2O.
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用如图2装置,加热15.0mL饱和氯水试样,测定产生气体的体积.此方案不可行的主要原因是因存在氯气的重新溶解以及次氯酸分解等,此方案无法测算试样含氯总量.(不考虑实验装置及操作失误导致不可行的原因)
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):量取一定量的试样,加入足量的H2O2溶液,充分反应,再加入足量的硝酸银溶液,称量沉淀质量.
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-.
实验一 制取氯酸钾和氯水
利用如图1所示的实验装置进行实验.

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有烧杯、漏斗、玻璃棒、胶头滴管.
(2)若对调B和C装置的位置,能(填“能”或“不能”)提高B中氯酸钾的产率.
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录如下(实验在室温下进行):
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.2mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
②设计1号试管实验的作用是硫酸浓度为0的对照实验.
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为ClO3-+6I-+6H+=Cl-+3I2+3H2O.
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用如图2装置,加热15.0mL饱和氯水试样,测定产生气体的体积.此方案不可行的主要原因是因存在氯气的重新溶解以及次氯酸分解等,此方案无法测算试样含氯总量.(不考虑实验装置及操作失误导致不可行的原因)
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):量取一定量的试样,加入足量的H2O2溶液,充分反应,再加入足量的硝酸银溶液,称量沉淀质量.
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-.