题目内容
11.将0.20mol•L-1的NH3•H2O溶液和0.10mol•L-1的HCl溶液等体积混合,充分反应后,下列有关该溶液中各粒子浓度的关系不正确的是( )| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(Cl-)+c(OH-) | ||
| C. | c(NH4+)+c(NH3•H2O)=0.10mol•L-1 | D. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
分析 将0.20mol•L-1的NH3•H2O溶液和0.10mol•L-1的HCl溶液等体积混合,充分反应后形成了等浓度的NH3•H2O与NH4Cl溶液,一水合氨的电离程度大于铵根离子的水解程度,溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒c(Na+)+c(H+)=c(Cl-)+c(OH-)可知:c(NH4+)>c(Cl-),则反应后溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),结合物料守恒判断.
解答 解:两溶液中和后形成了等浓度的NH3•H2O与NH4Cl溶液,由于前者的电离程度大于后者NH4+的水解程度,最终溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故A错误、D正确;
溶液中电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(OH-),故B正确;
N原子的物料守恒:c(NH4+)+c(NH3•H2O)=0.10mol•L-1,故C正确;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
1.已知X、Y、Z、W为原子序数依次增大的短周期主族元素,Z+与X3-具有相同的电子层结构,Y、W原子的价电子数目之和为13.下列有关说法中正确的是( )
| A. | 四种元素的原子半径:Z<Y<X<W | |
| B. | 化合物Z2Y与ZW中的化学键类型相同 | |
| C. | X与W两种元素的最简单氢化物间能发生化合反应 | |
| D. | 常温下,X和Y形成的所有化合物均为无色气体 |
2.下列反应的离子方程式书写正确的是( )
| A. | 锌粒与稀硝酸反应:Zn+2 H+═Zn2++H2↑ | |
| B. | 醋酸与氨水反应:CH3COOH+NH3•H2O═CH3COONH4+H2O | |
| C. | NH4Al(SO4)2与足量NaOH稀溶液反应5OH-+NH4++Al3+═AlO2-+NH3•H2O+2H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
19.有机化合物的 核磁共振氢谱有个峰( )
核磁共振氢谱有个峰( )
 核磁共振氢谱有个峰( )
核磁共振氢谱有个峰( )| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
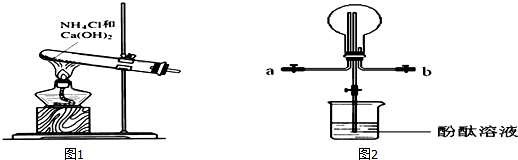
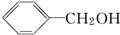 ,B为
,B为 (均填结构简式),A、B互为同分异构体;
(均填结构简式),A、B互为同分异构体;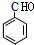 +2H2O.
+2H2O.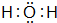 、
、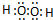 ,D、E形成的化合物
,D、E形成的化合物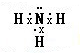 .
.