题目内容
6.下列实验可行的是( )| A. | 用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质 | |
| B. | 用乙醇从碘水中萃取碘 | |
| C. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| D. | 用食醋浸泡有水垢的水壶清除其中的水垢 |
分析 A.浓硝酸与蛋白质发生颜色反应,不是浓硫酸;
B.乙醇易溶于水,不能用乙醇萃取碘水中的碘单质;
C.酯化反应为可逆反应,无法用乙醇和浓硫酸除去乙酸,应该用饱和碳酸钠溶液;
D.醋酸能够与碳酸钙反应,可用食醋除去水壶中的水垢.
解答 解:A.鉴别部分带苯环的蛋白质,利用蛋白质遇到浓硝酸变黄,可以进行鉴别,浓硫酸不能,故A错误;
B.萃取是利用物质在两种互不相溶的溶剂中的溶解度不同,从一种溶剂中转移到另一种溶剂中,再利用分液、蒸馏的方法进行分离,乙醇与水溶液混溶,不分层,故B错误;
C.除去乙酸乙酯中的少量乙酸,应该用饱和碳酸钠溶液,碳酸钠能够溶解乙醇中和乙酸,降低酯的溶解度,静置后分液;用乙醇和浓硫酸与乙酸反应需加热且反应是可逆反应不可能除净,故C错误;
D.醋酸和水垢中的碳酸钙和氢氧化镁反应生成了溶于水的盐,除去水垢,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及蛋白质的性质,水垢的成分,物质的分离与提纯、萃取的依据等知识,明确常见元素及其化合物性质为解答关键,注意掌握化学实验基本操作方法,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
17.下列化学用语的书写正确的是( )
| A. | 羟基的电子式: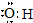 | |
| B. | 过氧化氢的电子式: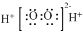 | |
| C. | As的原子的特征电子排布式:[Ar]4s14p3 | |
| D. | 基态Mg原子的核外电子排布图: |
14.1mol•L-1NaCl溶液的含义是( )
| A. | 1 L水中含有1 mol NaCl | |
| B. | 溶液中含有1 mol NaCl | |
| C. | 1 L溶液中含有1 molNaCl | |
| D. | 将58.5 g NaCl溶于1 L水中所得的溶液 |
15.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe2+、Al3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生沉淀;过滤、洗涤、灼烧,得到1.6g红棕色固体;向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
| A. | 至少存在4种离子 | |
| B. | Cl-一定存在,且c(Cl )≥0.4 mol/L | |
| C. | SO42-、NH4+,一定存在,Cl-可能不存在 | |
| D. | CO32-、Al3+一定不存在,K+可能存在 |
16.下列有关硅及其化合物的说法中正确的是( )
| A. | 硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中 | |
| B. | 反应①Na2SiO3+H2O+CO2═Na2CO3+H2SiO3↓,反应②Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$NaSiO3+CO2↑,两反应是相互矛盾的,不可能都发生 | |
| C. | 普通玻璃、石英玻璃、水泥等均属于硅酸盐材料 | |
| D. | 祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO•Al2O3•6SiO2 |
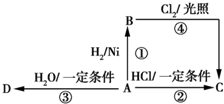 某烃A是有机化学工业的基础原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.
某烃A是有机化学工业的基础原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.