题目内容
13.2g Cu2S和CuS的混合物在酸性溶液中用400mL0.075mol/L KMnO4溶液处理,发生反应如下:①MnO4-+Cu2S+H+=Cu2++SO2+Mn2++H2O
②6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液赶尽SO2,剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应,反应式为:③MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
请回答:
(1)配平KMnO4与Cu2S反应的离子方程式:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
若标准状况下有1.12L SO2生成,则被还原的MnO4-物质的量是0.06mol.
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为0.007mol.
(3)混合物中Cu2S的质量分数为40%.
分析 (1)KMnO4与Cu2S反应中,Mn元素的化合价降低5,Cu、S元素的化合价升高,共升高8,结合电子、电荷及原子守恒配平及计算;
(2)剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应,利用MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O计算;
(3)根据金属化合物的质量和金属化合物与高锰酸钾反应的高锰酸钾的物质的量列方程式组,计算出硫化亚铜的质量,再根据质量分数计算方法计算即可.
解答 解:(1)KMnO4与Cu2S反应中,Mn元素的化合价降低5,Cu、S元素的化合价升高,共升高8,由电子、电荷及原子守恒可知,离子反应为8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O,标准状况下有1.12L SO2生成,其物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,由电子守恒可知被SO2还原的MnO4-物质的量是$\frac{0.05mol×6}{(7-2)}$=0.06mol,
故答案为:8;5;44;10;5;8;22;0.06 mol;
(2)设剩余的物质的量为x,则
MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O
1mol 5mol
xmol 0.350L×0.1mol/L
解得x=0.007,
故答案为:0.007;
(3)高锰酸钾的总物质的量为0.400L×0.075mol/L=0.03mol,所以KMnO4溶液与混合物反应,消耗KMnO4的物质的量为0.03mol-0.007mol=0.023mol,
设CuS、Cu2S的物质的量分别为x、y
8MnO4-+5Cu2S+44H+═10Cu2++5SO2+8Mn2++22H2O
$\frac{8}{5}$y y
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
$\frac{6x}{5}$ x
则96x+160y=2g,
$\frac{6}{5}$x+$\frac{8}{5}$y=0.023mol
解之得:x=0.0125mol y=0.005mol,所以Cu2S的质量为0.8g,CuS的质量为1.2g,
Cu2S的质量分数为$\frac{0.8g}{2g}$×100%=40%,
故答案为:40%.
点评 本题考查氧化还原反应计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应计算及转移电子的考查,注意从化合价角度分析,题目难度不大.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | K+、Na+、OH-、NO3- | B. | Cu2+、Ba2+、Cl-、NO3- | ||
| C. | Na+、Mg2+、OH-、SO42- | D. | Fe2+、H+、NO3-、ClO- |
| A. | 碘的升华 | B. | 石油分馏 | ||
| C. | 用苯萃取溴水中的溴 | D. | 煤的干馏 |
| A. | 浓H2SO4、NaOH-腐蚀品 | B. | 酒精-易燃气体 | ||
| C. | KMnO4-氧化剂 | D. | 白磷-易燃固体 |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
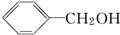 ,B为
,B为 (均填结构简式),A、B互为同分异构体;
(均填结构简式),A、B互为同分异构体;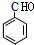 +2H2O.
+2H2O.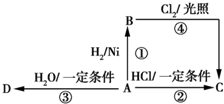 某烃A是有机化学工业的基础原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.
某烃A是有机化学工业的基础原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型. )
)