题目内容
11.某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.实验一 制取氯酸钾和氯水
利用如图1所示的实验装置进行实验.
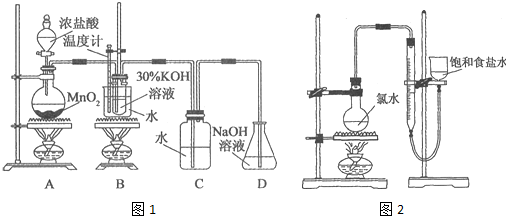
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有烧杯、漏斗、玻璃棒、胶头滴管.
(2)若对调B和C装置的位置,能(填“能”或“不能”)提高B中氯酸钾的产率.
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录如下(实验在室温下进行):
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.2mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
②设计1号试管实验的作用是硫酸浓度为0的对照实验.
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为ClO3-+6I-+6H+=Cl-+3I2+3H2O.
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用如图2装置,加热15.0mL饱和氯水试样,测定产生气体的体积.此方案不可行的主要原因是因存在氯气的重新溶解以及次氯酸分解等,此方案无法测算试样含氯总量.(不考虑实验装置及操作失误导致不可行的原因)
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):量取一定量的试样,加入足量的H2O2溶液,充分反应,再加入足量的硝酸银溶液,称量沉淀质量.
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-.
分析 实验一制取氯酸钾和氯水
A装置二氧化锰和浓盐酸来制取氯气,该反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,B装置:氯气与热的KOH溶液发生反应3Cl2+6KOH(浓)$\frac{\underline{\;\;△\;\;}}{\;}$5KCl+KClO3+3H2O,产生氯酸钾和氯化钾及水,挥发出的HCl极易溶于水,和氢氧化钾反应HCl+KOH=KCl+H2O,尾气用氢氧化钠吸收,Cl2+2NaOH=NaCl+NaClO+H2O,
(1)制取实验结束后,取出B中试管冷却结晶需要玻璃仪器烧杯、过滤、洗涤需要漏斗、玻璃棒、胶头滴管;
(2)实验室用二氧化锰和浓盐酸来制取氯气,制得的氯气中含有氯化氢,HCl极易溶于水,能和KOH反应生成KCl杂质,若对调B和C装置,可以除去氯化氢杂质,能提高B中氯酸钾的产率;
实验二氯酸钾与碘化钾反应的探究
(3)①根据表格数据分析:试管1、2、3、4中都是0.20mol•L-1KI/mL,KClO3(s)0.10g,改变的只有硫酸的体积和水的量,所以研究的目的就是研究反应体系中硫酸浓度对反应产物的影响;
②1号试管硫酸浓度未0,设计1号试管实验的作用是做对照实验,比较硫酸浓度对反应产物的影响;
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色说明有碘单质生成,假设氧化产物唯一,还原产物为氯化钾,根据氧化还原反应中电子守恒和原子守恒书写该反应的离子方程式;
实验三测定饱和氯水中氯元素的总量
(4)氯气能溶于水,次氯酸不稳定易分解生成氯化氢、氧气,因存在氯气的重新溶解以及次氯酸分解等,此方案无法测算试样含氯总量;
(5)根据题干信息次氯酸会破坏酸碱指示剂,因此实验设计时不用酸碱指示剂,可以利用氯水的强氧化性,向该溶液中加入足量的H2O2溶液,发生氧化还原,H2O2被氧化变为O2,氯气被还原成Cl-,然后加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,发生沉淀反应Ag++Cl-=AgCl↓产生沉淀,称量沉淀质量,根据氯元素守恒确定氯元素的质量.
解答 解:实验一制取氯酸钾和氯水
(1)制取实验结束后,取出B中试管,进行冷却结晶操作需要烧杯、过滤需要漏斗和玻璃棒,洗涤需要玻璃仪器烧杯盛放液体,需用玻璃棒引流、需用胶头滴管移取少量液体,
故答案为:烧杯、漏斗、玻璃棒、胶头滴管;
(2)实验室用二氧化锰和浓盐酸来制取氯气,制得的氯气中含有氯化氢,HCl极易溶于水,能和KOH反应生成KCl杂质,若对调B和C装置,可以除去氯化氢杂质,能提高B中氯酸钾的产率,
故答案为:能;
实验二氯酸钾与碘化钾反应的探究
(3)①根据表格数据分析:对照试管1、2、3、4中数据发现都是0.20mol•L-1KI/mL,KClO3(s)0.10g,改变的只有硫酸的体积和水的量,所以研究的目的是研究反应体系中硫酸浓度对反应产物的影响,
故答案为:研究反应体系中硫酸浓度对反应产物的影响;
②1号试管硫酸浓度为0,设计1号试管实验的作用是做对照实验,比较硫酸浓度影响反应产物,
故答案为:硫酸浓度为0的对照实验;
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色说明有碘单质生成,假设氧化产物唯一,还原产物为氯化钾,Cl(+5→-1)I(-1→0),根据氧化还原反应中电子守恒和原子守恒,该反应的离子方程式为:ClO3-+6I-+6H+=Cl-+3I2+3H2O,
故答案为:ClO3-+6I-+6H+=Cl-+3I2+3H2O;
实验三测定饱和氯水中氯元素的总量
(4)氯气能溶于水且能和水反应Cl2+H2O?HCl+HClO,次氯酸不稳定易分解2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,因存在氯气的重新溶解以及次氯酸分解等,此方案无法测算试样含氯总量,
故答案为:因存在氯气的重新溶解以及次氯酸分解等,此方案无法测算试样含氯总量;
(5)根据题干信息次氯酸会破坏酸碱指示剂,因此实验设计时不用酸碱指示剂,可以利用氯水的强氧化性,向该溶液中加入足量的H2O2溶液,发生氧化还原,H2O2被氧化变为O2,氯气被还原成Cl-,充分反应,再加入足量的硝酸银溶液,发生沉淀反应Ag++Cl-=AgCl↓产生沉淀,称量沉淀质量,根据氯元素守恒确定氯元素的质量,
故答案为:量取一定量的试样,加入足量的H2O2溶液,充分反应,再加入足量的硝酸银溶液,称量沉淀质量.
点评 本题考查氯及其化合物的性质,侧重考查化学仪器的使用、实验方案的设计与评价、离子方程式的书写等知识,掌握实验室制取氯气是解答的关键,题目难度中等.

| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 集中处理废旧电池,以防止重金属污染环境 | |
| B. | 海产品中加入大量甲醛以延长保鲜期 | |
| C. | 食用蔬菜水果可以补充人体所需维生素 | |
| D. | 使用加碘盐,可预防因缺碘引起的甲状腺肿大 |
| A. | 硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中 | |
| B. | 反应①Na2SiO3+H2O+CO2═Na2CO3+H2SiO3↓,反应②Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$NaSiO3+CO2↑,两反应是相互矛盾的,不可能都发生 | |
| C. | 普通玻璃、石英玻璃、水泥等均属于硅酸盐材料 | |
| D. | 祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO•Al2O3•6SiO2 |
①Na2O2+2H2O═2NaOH+H2O2
②IBr+H2O═HIO+HBr
③Cr2O72-+4H2O2+2H+═2CrO5+5H2O(CrO5的结构为
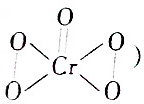 )
)| A. | ①②③ | B. | ② | C. | ③ | D. | 都不是 |
| A. | 等物质的量的CaCl2和CaO2含有的离子数 | |
| B. | 等质量的水与重水含有的电子数 | |
| C. | 同温、同压同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |

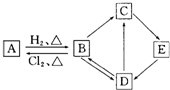 图中的每一方格表示相关的一种反应物或生成物.其中B是一种单质,其余物质也都是有B元素的化合物.C是一种钠盐,E是C的对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),请填写空白:
图中的每一方格表示相关的一种反应物或生成物.其中B是一种单质,其余物质也都是有B元素的化合物.C是一种钠盐,E是C的对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),请填写空白: