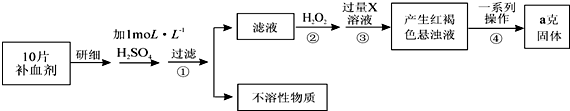
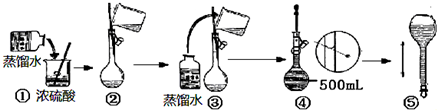
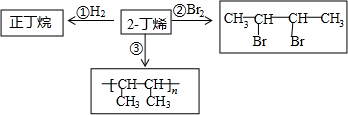
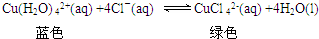题目内容
12.常温下0.1mol•L-1NaHSO3溶液,下列判断正确的是( )| A. | 溶质的电离方程式为NaHSO3═Na++H++SO32- | |
| B. | c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(HSO3-)与c(Na+)均增大 |
分析 A.亚硫酸氢钠完全电离生成钠离子和亚硫酸氢根离子;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.加入少量NaOH固体,NaOH和亚硫酸氢钠反应生成亚硫酸钠.
解答 解:A.亚硫酸氢钠完全电离生成钠离子和亚硫酸氢根离子,电离方程式为NaHSO3═Na++HSO3-,故A错误;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),故B正确;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),故C正确;
D.加入少量NaOH固体,NaOH和亚硫酸氢钠反应生成亚硫酸钠,亚硫酸根离子水解程度较小,则c(HSO3-)减小,故D错误;
故选BC.
点评 本题考查离子浓度大小比较、电解质的电离等知识点,为高频考点,明确溶质性质是解本题关键,注意电荷守恒和物料守恒的应用,亚硫酸根离子、碳酸氢根离子都是原子团不能拆开.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
3.下列关于自然界中氮循环示意图(如图)的说法错误的是( )

| A. | 氮元素只被氧化 | |
| B. | 豆科植物根瘤菌固氮属于自然固氮 | |
| C. | 其它元素也参与了氮循环 | |
| D. | 含氮无机物和含氮有机物可相互转化 |
7.已知,NO2和溴蒸汽都是红棕色气体,且都有强氧化性.在加压条件下,NO2可以发生如下反应:2NO2(g)?N2O4(g).下列试剂或方法中不能降NO2和溴蒸气区别开的是( )
| A. | 向两种气体中加入适量水,震荡 | B. | 将两种气体分别通入AgNO3溶液中 | ||
| C. | 用湿润的淀粉KI试纸检验 | D. | 将两种气体加压、冷却 |
17.下列分散系中,适宜用过滤的方法将分散质与分散剂分离的是( )
| A. | 溶液 | B. | 胶体 | ||
| C. | 悬浊液 | D. | 互不相容的两种液体 |
4.标准状况下,112ml,某气体的质量为0.29g,该气体的摩尔质量约为( )
| A. | 29g•mol-1 | B. | 29g | C. | 58g•mol-1 | D. | 58g |
13. 以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )
以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )
 以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )
以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )| A. | 电解前CuSO4溶液的物质的量浓度为2mol/L | |
| B. | 电解后所得溶液中c(H+)=2mol/L | |
| C. | 当n(e-)=0.6mol时,V(H2):V(O2)=2:3 | |
| D. | 向电解后的溶液中加入16gCuO,则溶液可恢复为电解前的浓度 |