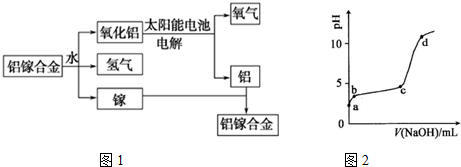
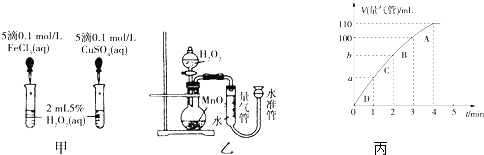
题目内容
13. 以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )
以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )| A. | 电解前CuSO4溶液的物质的量浓度为2mol/L | |
| B. | 电解后所得溶液中c(H+)=2mol/L | |
| C. | 当n(e-)=0.6mol时,V(H2):V(O2)=2:3 | |
| D. | 向电解后的溶液中加入16gCuO,则溶液可恢复为电解前的浓度 |
分析 石墨电极电解200mL CuSO4溶液,先发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,后发生2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,结合图象可知,生成2.24L气体时转移0.4mol电子发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,以此来计算解答.
解答 解:A.由生成2.24L气体时转移0.4mol电子发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,则n(CuSO4)=$\frac{2.24L}{22.4L/mol}$×2=0.2mol,c(CuSO4)=$\frac{0.2mol}{0.2L}$=1mol/L,故A错误;
B.生成2.24L气体时转移0.4mol电子,当转移0.4mol电子时,生成n(H2SO4)=0.2mol,c(H+)=$\frac{0.2mol×2}{0.2L}$=2mol/L,随电解的进行,水继续电解,溶剂减小,则电解后所得溶液中c(H+)>2mol/L,故B错误;
C.当n(e-)=0.6mol时,发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4、2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑~4e-,n(H2)=$\frac{0.2mol×2}{4}$=0.1mol,n(O2)=0.1mol+0.05mol=0.15mol,所以V(H2):V(O2)=0.1mol:0.15mol=2:3,故C正确;
D.因电解后从溶液中析出Cu、氧气、水,则加入16gCuO不会恢复为电解前的浓度,故D错误;
故选C.
点评 本题考查电解原理及计算,明确发生的电解反应及图象中体积与转移电子的关系即可解答,注意从溶液中析出Cu、氧气、水结合电解反应中转移的电子数来计算,题目难度中等.

| A. | 溶质的电离方程式为NaHSO3═Na++H++SO32- | |
| B. | c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(HSO3-)与c(Na+)均增大 |
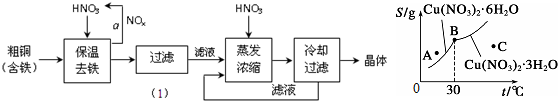
| A. | C点溶液为Cu(NO3)2的不饱和溶液 | |
| B. | 30℃时结晶可析出两种晶体 | |
| C. | 按上述流程最终得到的晶体是Cu(NO3)2•3H2O | |
| D. | 将A点溶液升温至30℃时,可以析出Cu(NO3)2•3H2O晶体. |
(1)常温下,浓度均为 0.1mol•L-1 的下列五种钠盐溶液的 pH 如表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100ml 0.1mol/L NaHCO3②100ml 0.1mol/L Na2CO3 两种溶液:
溶液中水电离出的H+个数:①<②(填“>”、“=”或“<”,下同).
溶液中阴离子的物质的量浓度之和:①>②.
( 3 ) NaHCO3是一种强(填“强”或“弱”)电解质;写出HCO${\;}_{3}^{-}$水解的离子方程式:HCO3-+H2O?H2CO3+OH-,常温下,0.1mol•L-1NaHCO3溶液的pH大于8,则溶液中 Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
(4)实验室中常用 NaOH 来进行洗气和提纯.
①当 150ml 1mol/L 的 NaOH 溶液吸收标准状况下 2.24LCO2时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②几种离子开始沉淀时的 PH 如表:
| 离子 | Fe 2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
(KspCu(OH)2=2×10mol•L )
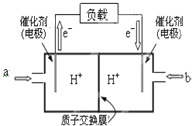 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)如图是某笔记本电脑用甲醇燃料电池的结构示意图.放电时甲醇应从a处通入(填“a”或“b”),电池内部H+向右(填“左”或“右”)移动.写出电池负极的电极反应式:CH3OH-6e-+H2O=CO2+6H+.
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算2C(s,石墨)+H2(g)=C2H2(g)反应的焓变△H=+226.7kJ•mol-1.
| A. | 溶液质量与白色固体的质量均保持不变 | |
| B. | 溶液浓度和pH值均保持不变,溶液下部是1.73g氢氧化钡固体 | |
| C. | 溶液中钡离子与氢氧根离子的数目均保持不变,${\;}^{1{8}^{\;}}$O存在于溶液和固体中,固体质量大于1.73克 | |
| D. | 溶液中钡离子与氢氧根离子的物质的量的浓度保持不变,${\;}^{1{8}^{\;}}$O存在于溶液和固体中,固体质量大于1.73克 |
 .
.