题目内容
14.2-丁烯(CH2-CH═CH-CH2)是石油裂解的产物之一,它存在以下转化关系: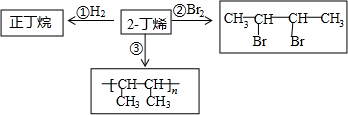
(1)正丁烷的结构简式为CH3(CH2)2CH3,它的同分异构体的结构简式为(CH3)2CHCH3
(2)甲烷是丁烷的同系物,写出甲烷与Cl2在光照条件下反应生成一氯甲烷的化学方程式:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl反应类型为取代反应
(3)写出框图中反应②的化学方程式CH3-CH═CH-CH3+Br2→CH3-CHBr-CHBr-CH3,反应类型为加成反应.
分析 (1)正丁烷主链有4个碳的烷烃;同分异构体是分子式相同,但结构不同的化合物,丁烷的两种同分异构体分别为主链含4个C的丁烷、主链为3个C的2-甲基丙烷;
(2)甲烷与氯气光照下发生取代反应生成一氯甲烷和HCl;
(3)2-丁烯与溴发生加成反应生成2,3-二溴丁烷;
解答 解:(1)正丁烷主链有4个碳的烷烃,结构简式为:CH3(CH2)2CH3;正丁烷的同分异构体为异丁烷,结构简式为(CH3)2CHCH3;
(2)甲烷与氯气光照下发生取代反应生成一氯甲烷和HCl,反应为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;取代反应;
(3)2-丁烯与溴发生加成反应生成2,3-二溴丁烷,化学方程式:CH3-CH═CH-CH3+Br2→CH3-CHBr-CHBr-CH3;
故答案为:CH3-CH═CH-CH3+Br2→CH3-CHBr-CHBr-CH3;
点评 本题考查了有机物结构简式、同分异构体的书写,化学方程式的书写,熟悉常见有机物结构特点及性质是解题关键,题目难度不大.

练习册系列答案
相关题目
12.常温下0.1mol•L-1NaHSO3溶液,下列判断正确的是( )
| A. | 溶质的电离方程式为NaHSO3═Na++H++SO32- | |
| B. | c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(HSO3-)与c(Na+)均增大 |
5. 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
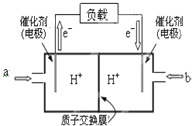
(2)如图是某笔记本电脑用甲醇燃料电池的结构示意图.放电时甲醇应从a处通入(填“a”或“b”),电池内部H+向右(填“左”或“右”)移动.写出电池负极的电极反应式:CH3OH-6e-+H2O=CO2+6H+.
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2(g)+3H2(g)?2NH3(g)△H=-93kJ•mol-1.试根据表中所列键能数据计算a 的数值:+391 kJ•mol-1.
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算2C(s,石墨)+H2(g)=C2H2(g)反应的焓变△H=+226.7kJ•mol-1.
 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)如图是某笔记本电脑用甲醇燃料电池的结构示意图.放电时甲醇应从a处通入(填“a”或“b”),电池内部H+向右(填“左”或“右”)移动.写出电池负极的电极反应式:CH3OH-6e-+H2O=CO2+6H+.
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算2C(s,石墨)+H2(g)=C2H2(g)反应的焓变△H=+226.7kJ•mol-1.
2.在恒定温度下,向100克饱和Ba(OH)2溶液中加入1.55克由${\;}^{1{8}^{\;}}$O组成的氧化钡粉末,充分反应后静置,在溶液下部有白色固体出现,下列叙述正确的是( )
| A. | 溶液质量与白色固体的质量均保持不变 | |
| B. | 溶液浓度和pH值均保持不变,溶液下部是1.73g氢氧化钡固体 | |
| C. | 溶液中钡离子与氢氧根离子的数目均保持不变,${\;}^{1{8}^{\;}}$O存在于溶液和固体中,固体质量大于1.73克 | |
| D. | 溶液中钡离子与氢氧根离子的物质的量的浓度保持不变,${\;}^{1{8}^{\;}}$O存在于溶液和固体中,固体质量大于1.73克 |
19.如图是向MgCl2、AlCl3混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质的量y(mol) 与试剂体积V(ml)间的关系.以下结论不正确的是( )
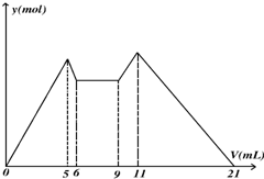

| A. | 原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| B. | A是NaOH,B是盐酸,且c(NaOH):c(HCl)=2:1 | |
| C. | 若A,B均为一元强酸或者一元强碱,则V(A):V(B)=7:13 | |
| D. | 从6到9,相应离子反应式H++OH-═H2O |
6.下列各组同体积、同物质的量浓度的溶液混合后,所得溶液的pH不大于7的是( )
①CH3COONa、HCl、NaHCO3②Na2S、KNO3、KCl③Ba(NO3)2、NH4Cl、Na2CO3④AgNO3、HCl、CH3COONa⑤K2CO3、HCl、HNO3⑥KCl、Na2S、HCl.
①CH3COONa、HCl、NaHCO3②Na2S、KNO3、KCl③Ba(NO3)2、NH4Cl、Na2CO3④AgNO3、HCl、CH3COONa⑤K2CO3、HCl、HNO3⑥KCl、Na2S、HCl.
| A. | ①③⑤ | B. | ③④⑤ | C. | ①②⑥ | D. | ②④⑥ |
4.下列各组离子,能大量共存于同一溶液中的是( )
| A. | CO32-、H+、Na+、NO3- | B. | H+、Ag+、Cl-、SO42- | ||
| C. | K+、Na+、OH-、SO42- | D. | Ba2+、Ca2+、SO42-、OH- |
