题目内容
17.下列分散系中,适宜用过滤的方法将分散质与分散剂分离的是( )| A. | 溶液 | B. | 胶体 | ||
| C. | 悬浊液 | D. | 互不相容的两种液体 |
分析 难溶性固体和溶液采用过滤方法分离,互不相溶的液体采用分液方法分离,互溶的液体采用蒸馏方法分离,据此分析解答.
解答 解:难溶性固体和溶液采用过滤方法分离,互不相溶的液体采用分液方法分离,互溶的液体采用蒸馏方法分离,悬浊液中含有难溶性固体和溶液,则适宜用过滤的方法将分散质与分散剂分离的是悬浊液,胶体采用渗析的方法分离,故选C.
点评 本题考查物质分离和提纯,为高频考点,明确物质性质及物质分离提纯关系是解本题关键,利用物质差异性进行分离和提纯,题目难度不大.

练习册系列答案
相关题目
8.对于1mol/L盐酸与铁片的反应,下列措施不能使产生H2反应速率加快的是( )
| A. | 加入一小块铜片 | B. | 改用等体积 98%的硫酸 | ||
| C. | 用等量铁粉代替铁片 | D. | 改用等体积3mol/L盐酸 |
12.常温下0.1mol•L-1NaHSO3溶液,下列判断正确的是( )
| A. | 溶质的电离方程式为NaHSO3═Na++H++SO32- | |
| B. | c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(HSO3-)与c(Na+)均增大 |
18.钠及其化合物具有广泛的用途.
(1)常温下,浓度均为 0.1mol•L-1 的下列五种钠盐溶液的 pH 如表;
上述盐溶液中的阴离子,结合H+能力最强的是CO32-,根据表中数据,浓度均为0.01mol•L-1 的下列四种酸的溶液分别稀释 100倍,pH变化最大的是C(填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100ml 0.1mol/L NaHCO3②100ml 0.1mol/L Na2CO3 两种溶液:
溶液中水电离出的H+个数:①<②(填“>”、“=”或“<”,下同).
溶液中阴离子的物质的量浓度之和:①>②.
( 3 ) NaHCO3是一种强(填“强”或“弱”)电解质;写出HCO${\;}_{3}^{-}$水解的离子方程式:HCO3-+H2O?H2CO3+OH-,常温下,0.1mol•L-1NaHCO3溶液的pH大于8,则溶液中 Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
(4)实验室中常用 NaOH 来进行洗气和提纯.
①当 150ml 1mol/L 的 NaOH 溶液吸收标准状况下 2.24LCO2时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②几种离子开始沉淀时的 PH 如表:
当向含相同浓度 Cu2+、Mg2+、Fe2+离子的溶液中滴加 NaOH 溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)2]<Ksp[Mg(OH)2](填“>”、“=”或“<”),要使 0.2mol/L 硫酸铜溶液中 Cu2+沉淀较为完全(使 Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为6.
(KspCu(OH)2=2×10mol•L )
(1)常温下,浓度均为 0.1mol•L-1 的下列五种钠盐溶液的 pH 如表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100ml 0.1mol/L NaHCO3②100ml 0.1mol/L Na2CO3 两种溶液:
溶液中水电离出的H+个数:①<②(填“>”、“=”或“<”,下同).
溶液中阴离子的物质的量浓度之和:①>②.
( 3 ) NaHCO3是一种强(填“强”或“弱”)电解质;写出HCO${\;}_{3}^{-}$水解的离子方程式:HCO3-+H2O?H2CO3+OH-,常温下,0.1mol•L-1NaHCO3溶液的pH大于8,则溶液中 Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
(4)实验室中常用 NaOH 来进行洗气和提纯.
①当 150ml 1mol/L 的 NaOH 溶液吸收标准状况下 2.24LCO2时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②几种离子开始沉淀时的 PH 如表:
| 离子 | Fe 2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
(KspCu(OH)2=2×10mol•L )
19.如图是向MgCl2、AlCl3混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质的量y(mol) 与试剂体积V(ml)间的关系.以下结论不正确的是( )
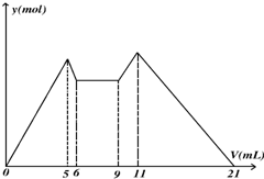

| A. | 原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| B. | A是NaOH,B是盐酸,且c(NaOH):c(HCl)=2:1 | |
| C. | 若A,B均为一元强酸或者一元强碱,则V(A):V(B)=7:13 | |
| D. | 从6到9,相应离子反应式H++OH-═H2O |