题目内容
3.(1)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物.请写出该反应的离子方程式8Fe2++NO3-+10H+=8Fe3++NH4++3H2O.
(2)实验室用NaCl固体配制0.5mol/L的NaCl溶液500mL,有以下仪器;
①烧杯 ②100mL量筒 ③1000mL容量瓶④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)⑦胶头滴管配制时,必须使用的仪器有①④⑤⑥⑦(填序号),实验两次用到玻璃棒,其作用分别是搅拌、引流.
(3)有一瓶澄清的溶液,可有含有大量的NO3-、Fe3+、NH4+、H+、K+、Mg2+、Al3+、SO42-、Ba2+、CO32-、Cl-、I-,现进行如下实验:
①测知溶液显酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色;
③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
由此可以推断:
溶液中肯定存在的离子有H+、NH4+、Ba2+、I-.
溶液中不能确定是否存在的离子有K+、Cl-.
分析 (1)根据离子性质及化合价变化找出反应物和生成物离子,根据得失电子守恒、电荷守恒、原子守恒配平;
(2)根据实验操作步骤确定每步操作需要仪器,根据配制步骤判断玻璃棒的作用;
(3)①测知溶液显酸性,说明溶液中肯定含有H+,而H+与CO32-反应发生反应而不能共存;
②CCl4层呈紫红色,说明有I2,这是由于I-被氯气氧化所产生的,从而说明溶液中含有I-,而与I-反应的离子不能共存;
③另取样滴加稀NaOH溶液,溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,而Fe3+、Mg2+、Al3+能与碱反应产生沉淀,与现象矛盾;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀,说明溶液中肯定含有Ba2+;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝根据澄清溶液得,气体为氨气,据此解答即可.
解答 解:(1)亚铁离子具有还原性,硝酸具有氧化性,则根据得失电子守恒、电荷守恒、原子守恒,反应离子方程式为:8Fe2++NO3-+10H+=8Fe3++NH4++3H2O,
故答案为:8Fe2++NO3-+10H+=8Fe3++NH4++3H2O;
(2)配制溶液的操作步骤:首先计算出需要的药品的质量,然后用托盘天平称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500mL容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2CM时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.用到的仪器有:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故必须使用的仪器是①④⑤⑥⑦,实验中两次用到玻璃棒,溶解氢氧化钠溶液时需要使用玻璃棒搅拌、转移溶液时用玻璃棒引流,
故答案为:①④⑤⑥⑦;搅拌、引流;
(3)①溶液呈强酸性,说明溶液中肯定含有H+,而H+与CO32-反应发生反应而不能共存,说明溶液中肯定不含有CO32-;
②CCl4层呈紫红色,说明有I2,这是由于I-被氯气氧化所产生的,从而说明溶液中含有I-,而I-与Fe3+、NO3-和H+能发生氧化还原反应,而不能共存,说明溶液中肯定不含有Fe3+、NO3-;
③溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,而Fe3+、Mg2+、Al3+能与碱反应产生沉淀,说明溶液中肯定不含有Fe3+、Mg2+、Al3+;
④取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,说明溶液中肯定含有Ba2+,而Ba2+能与SO42-产生沉淀,说明溶液中不含SO42-;
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则说明一定含有NH4+,
综上所述:一定存在的离子是H+、NH4+、Ba2+、I-,一定不存在的离子是Mg2+、Al3+、Fe3+、SO42-、CO32-、NO3-,不能确定的离子为:K+、Cl-;
故答案为:H+、NH4+、Ba2+、I-;K+、Cl-.
点评 本题以物质的性质为背景,考查了离子方程式书写、溶液的配置、物质的检验及鉴别等知识点,为高频考点,把握常见离子之间的反应、离子检验等为推断的关键,侧重分析与推断能力的综合考查,题目难度中等.

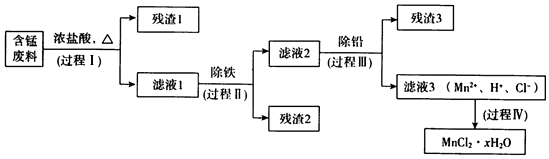
资料a:Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化.
资料b:
生成氢氧化物沉淀的pH
| Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 8.1 | 6.5 | 1.9 |
| 完全沉淀时 | 10.1 | 8.5 | 3.2 |
(1)过程I的目的是浸出锰.经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+.
①MnO2与浓盐酸反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无明显变化;另取少量滤液1于试管中,再滴加KSCN溶液,溶液变红.
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=4Fe3++2H2O
c.…
写出c的离子方程式:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O.
(2)过程Ⅱ的目的是除铁.有如下两种方法:
i.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤.
ii.焙烧法:将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物…
已知:焙烧中发生的主要反应为2FeCl3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3Cl2,焙烧时MnCl2和PbCl2不发生变化.
①氨水法除铁时,溶液pH应控制在3.2~6.5之间.
②补全ii中的操作:加水溶解,过滤,再加盐酸酸化至pH小于6.5.
③两种方法比较,氨水法除铁的缺点是引入杂质NH4+.
(3)过程Ⅲ的目的是除铅.加入的试剂是锰.
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g.则x=$\frac{{7({m_1}-{m_2})}}{m_2}$.
| A. | 16g O2和O3的混合气体中含有的分子数为0.5NA | |
| B. | 25℃时,KSP(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA | |
| C. | 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA | |
| D. | 常温下,1mol的NaHCO3固体中含HCO3-的数目为NA |
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
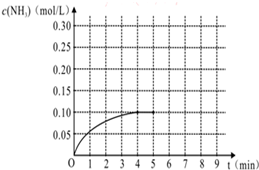 在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图:
在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图:
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.