题目内容
13.pH=3的盐酸和pH=11的氨水等体积混合,溶液中离子浓度关系正确的是( )| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
分析 氨水为弱碱,常温下pH=11的氨水中氢氧根离子浓度为0.001mol/L,则氨水的浓度大于0.001mol/L;pH=3的盐酸的物质的量浓度为0.001mol/L,两溶液等体积混合后氨水过量,溶液显示碱性,c(OH-)>c(H+),根据电荷守恒可知:c(NH4+)>c(Cl-),据此进行解答.
解答 解:pH=3的盐酸的物质的量浓度为0.001mol/L,
一水合氨为弱电解质,常温下pH=11的氨水中氢氧根离子浓度为0.001mol/L,氨水的浓度一定大于0.001mol/L,
两溶液等体积混合后,氨水过量,溶液呈碱性,则:c(OH-)>c(H+),根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)可知:c(NH4+)>c(Cl-),
所以溶液中各离子浓度大小为c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故选B.
点评 本题考查了溶液中离子浓度大小比较、酸碱混合的定性判断,题目难度中等,明确弱电解质的电离平衡特点为解答关键,注意电荷守恒、物料守恒、盐的水解原理在判断溶液中离子浓度大小中的应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.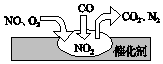 随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
 随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )| A. | 反应中NO为氧化剂,N2为氧化产物 | |
| B. | 汽车尾气的主要污染成分包括CO、NO和N2 | |
| C. | NO和O2必须在催化剂表面才能反应 | |
| D. | 催化转化总化学方程式为2NO+O2+4CO=4CO2+N2 |
1.设NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1.00mol NaCl中含有NA个NaCl 分子 | |
| B. | 常温常压下,22.4LCl2与足量镁粉反应,转移的电子数为2NA | |
| C. | 一定条件下,2.3gNa与足量O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| D. | 28g乙烯和环丙烷(C3H6)组成的混合气体中含有氢原子的个数为3 NA |
18.汽车尾气中所含污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有( )
| A. | 氮气 | B. | 硫化氢 | C. | 氨气 | D. | 氮的氧化物 |
5.碳酸亚铁(FeCO3)是一种重要的工业盐.某学习小组对用FeSO4制备FeCO3
资料显示:FeCO3:白色结晶,难溶于水;干燥品在空气中稳定,湿品暴露在空气中缓慢氧化生成红棕色的水合氧化铁FeO(OH.
(1)实验探究Ⅰ
①生成FeCO3离子方程式:Fe2++CO32-=FeCO3↓.
②反应过程中可能生成Fe(OH)2的依据是白色絮状变成灰绿色,最后变成红褐色.
③取沉淀离心、充分洗涤,加足量稀硫酸,沉淀溶解且有气泡产生,证明白色沉淀中含有CO32-;此时溶液中存在的金属阳离子有Fe3+、Fe2+.
(2)实验探究Ⅱ
①经检验,试管中白色颗粒状浑浊是FeCO3,请结合化学用语从平衡角度解释产生大量气泡的原因NaHCO3中存在电离平衡:HCO3-?H++CO32-,加FeSO4,Fe2++CO32-=FeCO3↓;平衡右移,H++HCO3-=CO2↑+H2O.
②分析现象认为:实验Ⅱ所得固体中FeCO3的含量比实验Ⅰ多.支持该结论的操作及现象如下:分别两种沉淀离心过滤、洗涤、干燥后称取等质量的两种固体,加足量稀硫酸沉淀均溶解,实验Ⅱ中产生的气体比实验Ⅰ中产生的气体多则结论成立.
(3)实验探究Ⅲ
实验改进的意图是反应放出CO2,给反应创设无O2的环境.
(4)综合以上实验,下列说法正确的是ad
a.用NaHCO3制得FeCO3纯度高的原因之一是因为NaHCO3溶液碱性弱
b.用1L 1.0mol/L NaHCO3与足量FeSO4溶液反应理论上可制备116g FeCO3
c.湿品FeCO3在空气中缓慢氧化的方程式为 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
d.工业上用NH4HCO3和FeSO4反应可制备纯度更高的FeCO3.
资料显示:FeCO3:白色结晶,难溶于水;干燥品在空气中稳定,湿品暴露在空气中缓慢氧化生成红棕色的水合氧化铁FeO(OH.
(1)实验探究Ⅰ
| 实 验 Ⅰ | 操作 | 现象 |
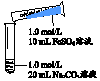 | 1、混合后出现白色絮状沉淀,振荡,部分沉淀呈灰绿色,无气泡产生 2、放置5-8分钟,灰绿色沉淀逐渐增多,最终变成红褐色 |
②反应过程中可能生成Fe(OH)2的依据是白色絮状变成灰绿色,最后变成红褐色.
③取沉淀离心、充分洗涤,加足量稀硫酸,沉淀溶解且有气泡产生,证明白色沉淀中含有CO32-;此时溶液中存在的金属阳离子有Fe3+、Fe2+.
(2)实验探究Ⅱ
| 实验Ⅱ | 操作 | 现象 |
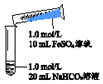 | 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、振荡,粘附在试管内壁的白色颗粒状浑浊变红棕色,且越来越多;20分钟后,白色浑浊明显沉降 |
②分析现象认为:实验Ⅱ所得固体中FeCO3的含量比实验Ⅰ多.支持该结论的操作及现象如下:分别两种沉淀离心过滤、洗涤、干燥后称取等质量的两种固体,加足量稀硫酸沉淀均溶解,实验Ⅱ中产生的气体比实验Ⅰ中产生的气体多则结论成立.
(3)实验探究Ⅲ
| 实验Ⅱ | 操作 | 现象 |
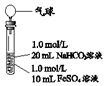 | 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、一段时间后将带有气球(排尽空气)的胶塞塞紧试管,振荡后放置5小时,气球膨胀,试管中沉淀物始终保持白色 |
(4)综合以上实验,下列说法正确的是ad
a.用NaHCO3制得FeCO3纯度高的原因之一是因为NaHCO3溶液碱性弱
b.用1L 1.0mol/L NaHCO3与足量FeSO4溶液反应理论上可制备116g FeCO3
c.湿品FeCO3在空气中缓慢氧化的方程式为 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
d.工业上用NH4HCO3和FeSO4反应可制备纯度更高的FeCO3.
2.下列说法正确的是 ( )
| A. | 钠、镁、铝原子半径依次增大 | B. | NH3H2O HF 稳定性依次减弱 | ||
| C. | H3PO4H2SO4HClO4酸性依次增强 | D. | NaOH Mg(OH)2 Al(OH)3碱性依次增强 |
3.下列反应的离子方程式书写正确的是( )
| A. | 氯化钠与浓硫酸混合加热:H2SO4(浓)+2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$SO${\;}_{4}^{2-}$+2HCl↑ | |
| B. | 过量的硫化钠溶液与氯化铁溶液反应:2Fe3++S2-═2Fe2++S↓ | |
| C. | 碳酸氢铵溶液与足量NaOH溶液混合后加热:NH${\;}_{4}^{+}$+HCO${\;}_{3}^{-}$+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO${\;}_{3}^{2-}$+NH3↑+2H2O | |
| D. | 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
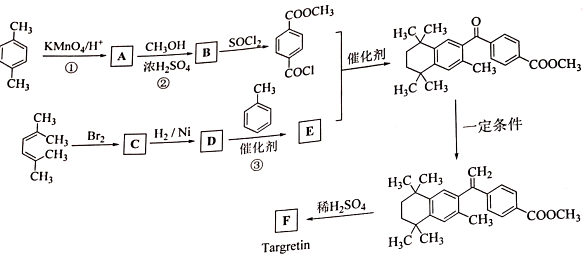
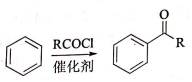 ②
②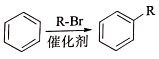
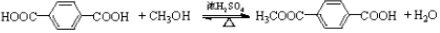 .
.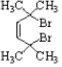 .
.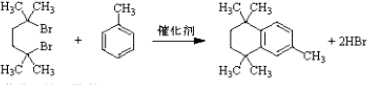 .
.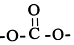 结构)
结构)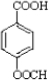 ,
,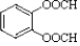 .
.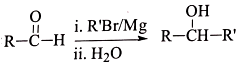 R-CH-R′(R、R′为烃基)
R-CH-R′(R、R′为烃基)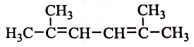 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).