题目内容
12.NaHCO3、NaCl的固体混合物30g,现将其加热一段时间后,冷却后称其质量为26.9g.在残存固体中加入足量澄清石灰水产生白色沉淀经过滤干燥称量得15克,则原混合物中NaCl的质量分数.分析 加热一段时间发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,导致固体质量减少,利用差量法计算参加反应的NaHCO3的质量,Na2CO3和生成的质量,此时残存固体为NaCl,Na2CO3,可能还含未反应的NaHCO3,将其通入足量澄清石灰水,发生的反应可能有Na2CO3+Ca(OH)2=CaCO3↓+NaOH,NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,并据沉淀15g,计算剩余的NaHCO3,从而得到NaCl的质量,并求其质量分数,据此进行分析.
解答 解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O~△m=44g+18g=62g,
168 106 62
8.4 5.3 30-26.9
则:m1(NaHCO3)=8.4g,m(Na2CO3)=5.3g,
Na2CO3+Ca(OH)2=CaCO3↓+NaOH
106 100
5.3 5
则m(CaCO3)=5g<15g,故还含未反应的NaHCO3,
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
84 100
8.4 15-5
则:m2(NaHCO3)=8.4g,故则:m(NaHCO3)=8.4g+8.4g=16.8g,则m(NaCl)=30g-16.8g=13.2g,w(NaCl)=$\frac{13.2g}{30g}×100%$=44%,
答:原混合物中NaCl的质量分数为44%.
点评 本题考查混合物的计算,为高频考点,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,明确发生反应原理为解答关键,注意利用差量法进行计算.

| A. | Fe与A1的物质的量之比为1:1 | |
| B. | 混合气体中 NO为0.03mol,N2O0.12mol | |
| C. | 原HNO3溶液的浓度C=4.6mol/L | |
| D. | 反应中被还原的HNO3为0.18 mol |
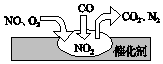 随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )| A. | 反应中NO为氧化剂,N2为氧化产物 | |
| B. | 汽车尾气的主要污染成分包括CO、NO和N2 | |
| C. | NO和O2必须在催化剂表面才能反应 | |
| D. | 催化转化总化学方程式为2NO+O2+4CO=4CO2+N2 |
| A. | 1.00mol NaCl中含有NA个NaCl 分子 | |
| B. | 常温常压下,22.4LCl2与足量镁粉反应,转移的电子数为2NA | |
| C. | 一定条件下,2.3gNa与足量O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| D. | 28g乙烯和环丙烷(C3H6)组成的混合气体中含有氢原子的个数为3 NA |
| A. | 钠、镁、铝原子半径依次增大 | B. | NH3H2O HF 稳定性依次减弱 | ||
| C. | H3PO4H2SO4HClO4酸性依次增强 | D. | NaOH Mg(OH)2 Al(OH)3碱性依次增强 |
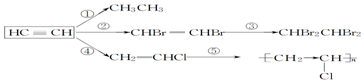
 ,加聚反应.
,加聚反应.