题目内容
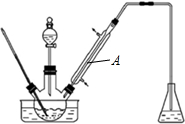
10.实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).附表:相关物质的沸点(101KPa)
| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机相用10%NaHCO3溶液洗涤.
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤.
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置A的名称是直型冷凝管,锥形瓶中的溶液应为NaOH.
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为AlCl3;
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的Br2、HCl(填化学式).
(4)步骤3中加入无水MgSO4固体的作用是除去有机相的水,分离的方法是过滤;
(5)步骤4中采用减压蒸馏技术,是为了防止间溴苯甲醛被氧化.
分析 苯甲醛与溴在氯化铝催化作用下在60℃时反应生成间溴苯甲醛,通式生成HBr,经冷凝回流可到间溴苯甲醛,生成的HBr用氢氧化钠溶液吸收,防止污染空气,有机相中含有Br2,加入HCl,可用碳酸氢钠除去,有机相加入无水MgSO4固体,可起到吸收水的作用,减压蒸馏,可降低沸点,避免温度过高,导致间溴苯甲醛被氧化,以此解答该题.
解答 解:(1)因溴易挥发,为使溴充分反应,应进行冷凝回流,根据仪器A的构造可知其名称为直形冷凝管;
反应发生取代反应,生成间溴苯甲醛的同时生成HBr,用氢氧化钠溶液吸收,防止污染空气,
故答案为:直型冷凝管;NaOH;
(2)将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合,三种物质中无水AlCl3为催化剂,1,2-二氯乙烷为溶剂,苯甲醛为反应物,
故答案为:AlCl3;
(3)将反应混合物含有溴,缓慢加入一定量的稀盐酸中,加入碳酸氢钠,可与Br2、HCl反应,
故答案为:Br2、HCl;
(4)经洗涤的有机相含有水,加入适量无水MgSO4固体,可起到除去有机相的水的作用;
硫酸镁不溶于有机层,可通过过滤操作分离,
故答案为:除去有机相的水;过滤;
(5)间溴苯甲醛中含有醛基,易被氧气,所以通过减压蒸馏,可降低沸点,避免温度过高,导致间溴苯甲醛被氧化,
故答案为:间溴苯甲醛被氧化.
点评 本题考查制备方案的设计,题目难度中等,侧重于学生的分析能力和实验能力的考查,明确基本实验操作方法以及实验的原理为解答关键,注意掌握制备方案设计与评价的原则.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
1.下列表达方式错误的是( )
| A. | HCl电子式:H:Cl | B. | S原子结构示意图: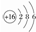 | ||
| C. | 10个中子的氧原子:${\;}_{8}^{18}$O | D. | CO2结构式:O═C═O |
18.下列变化中,不需要破坏化学键的是( )
| A. | 氯化氢溶于水 | B. | 氧化镁熔化 | ||
| C. | 加热氯酸钾使其分解 | D. | 碘升华 |
15.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入3mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A. | 100 mL | B. | 45 mL | C. | 10 mL | D. | 15 mL |
2.下列对分子性质的解释中,不正确的是( )
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 由于乳酸( )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体 | |
| C. | HF的稳定性很强,是因为其分子间能形成氢键 | |
| D. | 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子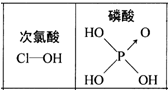 |
19.下列各组化合物中,属同系物的是( )
| A. | C2H6和C4H8 | B. | C3H6和C6H14 | C. | C8H18和C4H10 | D. | C5H12和C7H14 |
10.下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液,排气泡并调零;③检查滴定管是否漏水;④滴定;⑤滴加2-3滴指示剂于锥形瓶的待测液中;⑥用水洗涤.正确的操作顺序是( )
| A. | ③⑥①②⑤④ | B. | ⑤①②⑥④③ | C. | ⑤④③②①⑥ | D. | ③①②④⑤⑥ |
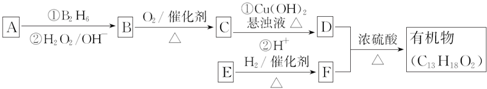
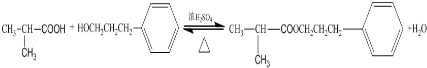 .E发生银镜反应的离子方程式为
.E发生银镜反应的离子方程式为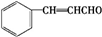 +2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$
+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ +2Ag↓+3NH3+NN4++H2O.
+2Ag↓+3NH3+NN4++H2O.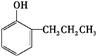 等.
等.