题目内容
18.下列变化中,不需要破坏化学键的是( )| A. | 氯化氢溶于水 | B. | 氧化镁熔化 | ||
| C. | 加热氯酸钾使其分解 | D. | 碘升华 |
分析 发生化学反应时物质中的化学键被破坏,熔化及电离过程中化学键也被破坏,以此来分析.
解答 解:A.氯化氢溶于水,氯化氢在水分子作用下电离出阴阳离子而破坏化学键,故A错误;
B.氧化镁熔化,氧化镁电离出镁离子和氧离子而破坏化学键,故B错误;
C.化学反应中有旧化学键的断裂,所以加热氯酸钾使其分解使其分解一定有化学键破坏,故C错误;
D.碘升华只是分子间距离的变化,没有发生化学键破坏,故D正确;
故选D.
点评 本题考查化学键,熟悉化学反应中、熔化、电离过程中的化学键变化是解答本题的关键,并注意利用分子间作用力不属于化学键来解答.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
8.分子式为C9H12的芳香烃的苯环上的一氯代物的数目为( )
| A. | 8种 | B. | 16种 | C. | 22种 | D. | 24种 |
13.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,第三周期中Z元素的简单离子半径最小,下列说法不正确的是( )
| X | Y | |||
| Z | W | Q |
| A. | Z位于第3周期 IIIA族 | |
| B. | X、Z、W、Q等元素的最高正价等于其所在族的族序数 | |
| C. | Y元素气态氢化物比W元素的气态氢化物更稳定,是因为前者分子间形成了氢键 | |
| D. | X的最高价氧化物对应的水化物和X的氢化物形成的化合物含有离子键、共价键 |
3.下列结论正确的是( )
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | ①②⑤⑦ | B. | ②③④⑥ | C. | ②④⑤⑥⑦ | D. | ①②⑥⑦ |
10.实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).
附表:相关物质的沸点(101KPa)
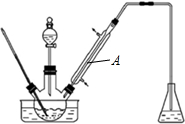
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机相用10%NaHCO3溶液洗涤.
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤.
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置A的名称是直型冷凝管,锥形瓶中的溶液应为NaOH.
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为AlCl3;
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的Br2、HCl(填化学式).
(4)步骤3中加入无水MgSO4固体的作用是除去有机相的水,分离的方法是过滤;
(5)步骤4中采用减压蒸馏技术,是为了防止间溴苯甲醛被氧化.
附表:相关物质的沸点(101KPa)
| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |

其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机相用10%NaHCO3溶液洗涤.
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤.
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置A的名称是直型冷凝管,锥形瓶中的溶液应为NaOH.
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为AlCl3;
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的Br2、HCl(填化学式).
(4)步骤3中加入无水MgSO4固体的作用是除去有机相的水,分离的方法是过滤;
(5)步骤4中采用减压蒸馏技术,是为了防止间溴苯甲醛被氧化.
8.不能正确表示下列反应的离子方程式是( )
| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 含有amolFeBr2的溶液中,通入0.4amolCl2:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 用两块铜片作电极电解盐酸:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cu2+ |
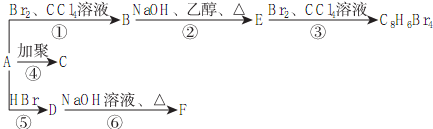
 ,D
,D ,E
,E .
.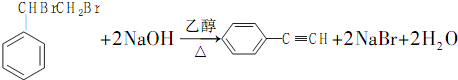 .
.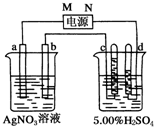 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.