题目内容
10.下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液,排气泡并调零;③检查滴定管是否漏水;④滴定;⑤滴加2-3滴指示剂于锥形瓶的待测液中;⑥用水洗涤.正确的操作顺序是( )| A. | ③⑥①②⑤④ | B. | ⑤①②⑥④③ | C. | ⑤④③②①⑥ | D. | ③①②④⑤⑥ |
分析 根据中和滴定有:检漏、洗涤、润洗、装液、取待测液并滴加指示剂、滴定等操作分析判断.
解答 解:中和滴定有:检漏、洗涤、润洗、装液、取待测液并滴加指示剂、滴定等操作,可知正确的顺序是③⑥①②⑤④,故选A.
点评 本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的原理、步骤、方法以及注意事项.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
10.实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).
附表:相关物质的沸点(101KPa)
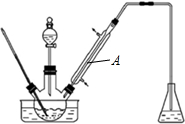
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机相用10%NaHCO3溶液洗涤.
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤.
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置A的名称是直型冷凝管,锥形瓶中的溶液应为NaOH.
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为AlCl3;
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的Br2、HCl(填化学式).
(4)步骤3中加入无水MgSO4固体的作用是除去有机相的水,分离的方法是过滤;
(5)步骤4中采用减压蒸馏技术,是为了防止间溴苯甲醛被氧化.
附表:相关物质的沸点(101KPa)
| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |

其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机相用10%NaHCO3溶液洗涤.
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤.
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置A的名称是直型冷凝管,锥形瓶中的溶液应为NaOH.
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为AlCl3;
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的Br2、HCl(填化学式).
(4)步骤3中加入无水MgSO4固体的作用是除去有机相的水,分离的方法是过滤;
(5)步骤4中采用减压蒸馏技术,是为了防止间溴苯甲醛被氧化.
11.化学与工农业生产和人类生活密切相关,下列说法正确的是( )
| A. | 向汽油中添加乙醇后,该混合燃料的热值不变,但可以达到减排的目的 | |
| B. | 侯氏制碱法的工艺流程应用了物质溶解度的差异 | |
| C. | 光导纤维、氧化铝陶瓷、PE、硅藻土都是无机非金属材料,橡胶、酚醛树脂都是人工合成高分子材料 | |
| D. | 泡沫灭火器是常见灭火器之一,其内筒为塑料桶,盛有碳酸氢钠溶液,外筒为金属材质,内外筒之间盛装硫酸铝溶液 |
8.不能正确表示下列反应的离子方程式是( )
| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 含有amolFeBr2的溶液中,通入0.4amolCl2:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 用两块铜片作电极电解盐酸:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cu2+ |
5.在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而与稀硫酸几乎不反应.这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致.为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象.
实验用品:仪器(略,凡是实验需要的均有提供)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况.结果如下:
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显.
(1)写出铝与盐酸反应的离子方程式是2Al+6H+═2Al3++3H2↑
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是反应放出热量,温度升高,使化学反应速率加快.
(3)将实验2中硫酸的浓度设计为1.5mol/L的依据是统一氢离子的浓度,比较阴离子在反应中的不同作用
(4)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:促进金属铝表面的氧化膜与H+反应
假设二:对金属铝表面的氧化膜与H+反应起阻碍作用.
实验用品:仪器(略,凡是实验需要的均有提供)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况.结果如下:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 | |
| 实验1 | 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 实验2 | 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 实验3 | 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
(1)写出铝与盐酸反应的离子方程式是2Al+6H+═2Al3++3H2↑
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是反应放出热量,温度升高,使化学反应速率加快.
(3)将实验2中硫酸的浓度设计为1.5mol/L的依据是统一氢离子的浓度,比较阴离子在反应中的不同作用
(4)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:促进金属铝表面的氧化膜与H+反应
假设二:对金属铝表面的氧化膜与H+反应起阻碍作用.
2.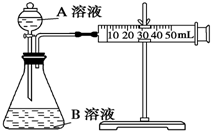 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
(1)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
实验探究的是浓度和催化剂对化学反应速率的影响.在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是③②① (用实验序号填空).
(2)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.
取两支试管各加入2mL 0.1mol/L H2C2O4溶液,另取两支试管各加入4mL 0.1mol/L KMnO4溶液.将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对化学反应速率的影响,但该组同学始终没有看到溶液明显褪色,其原因是KMnO4溶液过量.
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.(1)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
| 序号 | A | B |
| 1 | 2ml0.1mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液 |
| 2 | 2ml0.2mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液 |
| 3 | 2ml0.2mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液和少量MnSO4溶液 |
(2)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.
取两支试管各加入2mL 0.1mol/L H2C2O4溶液,另取两支试管各加入4mL 0.1mol/L KMnO4溶液.将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对化学反应速率的影响,但该组同学始终没有看到溶液明显褪色,其原因是KMnO4溶液过量.
19.已知反应2SO2(g)+O2(g)?2SO3(g),一定条件下发生反应生成2molSO3,放出热量为197KJ.若在相同条件下,向密闭容器中通入2mol SO2和1molO2,反应达到平衡时放出热量Q,则下列关系式正确的是( )
| A. | Q=197KJ | B. | Q<197×2 KJ | C. | Q<197KJ | D. | Q>197KJ |
