题目内容
5.原子序数依次增大的 A、B、C、D、E五种短周期主族元素,A、B、C分布于三个不同的周期中.D的原子序数是B的两倍,元素D的单质在反应中能置换出元素B的单质,E是同周期元素原子半径最小的元素.问:(1)B在元素周期表的位置第二周期、第VIA族.
(2)A与C形成化合物的电子式为Na+[:H]-;该化合物与水反应的化学方程式是NaH+H2O=NaOH+H2↑
(3)D的单质置换出B的单质的方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(4)从化合价角度分析,有人认为元素A在元素周期表中的位置可以放在IA族、VⅡA族或ⅣA族.
分析 原子序数依次增大的 A、B、C、D、E五种短周期主族元素,A、B、C分布于三个不同的周期中,则A为H,B为第二周期元素,C为第三周期元素;D的原子序数是B的两倍,元素D的单质在反应中能置换出元素B的单质,则D为Mg,B为C,结合原子序数可知C为Na,E是同周期元素原子半径最小的元素,则E为Cl,然后结合元素周期律及元素化合物知识来解答.
解答 解:原子序数依次增大的 A、B、C、D、E五种短周期主族元素,A、B、C分布于三个不同的周期中,则A为H,B为第二周期元素,C为第三周期元素;D的原子序数是B的两倍,元素D的单质在反应中能置换出元素B的单质,则D为Mg,B为C,结合原子序数可知C为Na,E是同周期元素原子半径最小的元素,则E为Cl,
(1)B在元素周期表的位置为第二周期、第VIA族,故答案为:第二周期、第VIA族;
(2)A与C形成化合物的电子式为Na+[:H]-;该化合物与水反应的化学方程式是 NaH+H2O=NaOH+H2↑,故答案为:Na+[:H]-;NaH+H2O=NaOH+H2↑;
(3)D的单质置换出B的单质的方程式为2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(4)H有+1价,可在IA族,H有-1价,可在VⅡA族,且最高正价与最低负价倒数和为0,可在ⅣA族,故答案为:IA;VⅡA;ⅣA.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置推断元素为解答的关键,侧重分析与推断能力的考查,注意周期律及元素化合物知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
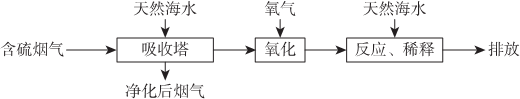
下列说法错误的是( )

下列说法错误的是( )
| A. | 天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解 | |
| B. | “氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42- | |
| C. | “反应、稀释”时加天然海水的目的是防止净化海水时生成沉淀 | |
| D. | “排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同. |
13.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,第三周期中Z元素的简单离子半径最小,下列说法不正确的是( )
| X | Y | |||
| Z | W | Q |
| A. | Z位于第3周期 IIIA族 | |
| B. | X、Z、W、Q等元素的最高正价等于其所在族的族序数 | |
| C. | Y元素气态氢化物比W元素的气态氢化物更稳定,是因为前者分子间形成了氢键 | |
| D. | X的最高价氧化物对应的水化物和X的氢化物形成的化合物含有离子键、共价键 |
20.据报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程如图:下列说法中不正确的是( )
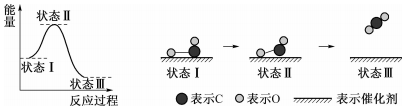

| A. | 状态Ⅰ→状态Ⅲ是放热过程 | |
| B. | 该过程中,CO没有断键形成C和O | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O生成了CO2 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 |
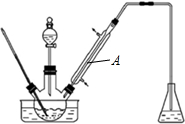
10.实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).
附表:相关物质的沸点(101KPa)
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机相用10%NaHCO3溶液洗涤.
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤.
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置A的名称是直型冷凝管,锥形瓶中的溶液应为NaOH.
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为AlCl3;
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的Br2、HCl(填化学式).
(4)步骤3中加入无水MgSO4固体的作用是除去有机相的水,分离的方法是过滤;
(5)步骤4中采用减压蒸馏技术,是为了防止间溴苯甲醛被氧化.
附表:相关物质的沸点(101KPa)
| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |

其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机相用10%NaHCO3溶液洗涤.
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤.
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置A的名称是直型冷凝管,锥形瓶中的溶液应为NaOH.
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为AlCl3;
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的Br2、HCl(填化学式).
(4)步骤3中加入无水MgSO4固体的作用是除去有机相的水,分离的方法是过滤;
(5)步骤4中采用减压蒸馏技术,是为了防止间溴苯甲醛被氧化.
17.下列有机物中属于醇的是( )
| A. |  | B. |  | C. |  | D. | CH3-O-CH3 |
14.下列关于卤族元素的说法正确的是( )
| A. | F、Cl、Br、I最高正化合价都为+7 | |
| B. | 卤族元素的单质只有氧化性 | |
| C. | 从F到I,原子的得电子能力依次减弱 | |
| D. | 卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由难变易 |
5.在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而与稀硫酸几乎不反应.这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致.为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象.
实验用品:仪器(略,凡是实验需要的均有提供)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况.结果如下:
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显.
(1)写出铝与盐酸反应的离子方程式是2Al+6H+═2Al3++3H2↑
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是反应放出热量,温度升高,使化学反应速率加快.
(3)将实验2中硫酸的浓度设计为1.5mol/L的依据是统一氢离子的浓度,比较阴离子在反应中的不同作用
(4)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:促进金属铝表面的氧化膜与H+反应
假设二:对金属铝表面的氧化膜与H+反应起阻碍作用.
实验用品:仪器(略,凡是实验需要的均有提供)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况.结果如下:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 | |
| 实验1 | 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 实验2 | 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 实验3 | 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
(1)写出铝与盐酸反应的离子方程式是2Al+6H+═2Al3++3H2↑
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是反应放出热量,温度升高,使化学反应速率加快.
(3)将实验2中硫酸的浓度设计为1.5mol/L的依据是统一氢离子的浓度,比较阴离子在反应中的不同作用
(4)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:促进金属铝表面的氧化膜与H+反应
假设二:对金属铝表面的氧化膜与H+反应起阻碍作用.