题目内容
20.有机香料的分子式为C13H18O2,其合成路线如图所示:已知:R-CH═CH2$→_{②H_{2}O_{2}/OH-}^{①B_{2}H_{6}}$R-CH2CH2OH
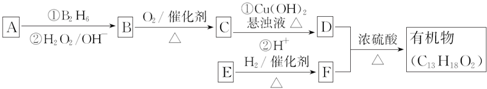
通过质谱法测得A的相对分子质量为56,它的核磁共振氢谱显示有两组峰且峰面积之比为1:3;D分子中含有支链;E能发生银镜反应,在催化剂存在下1mol E与2mol H2可以发生反应生成F,且F分子中含有苯环但无甲基.请回答:
(1)A中所含官能团的名称为碳碳双键;A生成B的反应类型是加成反应.
(2)C的结构简式为(CH3)2CHCHO.
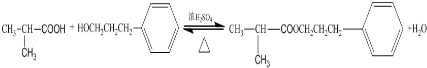
(3)D与F反应的化学方程式为
 .E发生银镜反应的离子方程式为
.E发生银镜反应的离子方程式为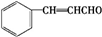 +2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$
+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ +2Ag↓+3NH3+NN4++H2O.
+2Ag↓+3NH3+NN4++H2O.(4)符合下列条件:①遇FeCl3溶液显紫色、②苯环上有两个取代基的F的同分异构体有6种,写出其中一种物质的结构简式
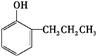 等.
等.
分析 有机物A发生信息中的反应生成B,A应属于烃类,其相对分子质量为56,则$\frac{56}{12}$=4…8,可知A的分子式为C4H8,A的核磁共振氢谱有2组峰且峰面积之比为1:3,B可以连续发生氧化反应,则A为(CH3)2C=CH2,B的结构简式为(CH3)2CHCH2OH,C的结构简式为(CH3)2CHCHO,D的结构简式为(CH3)2CHCOOH,D和F反应生成有机物C13H18O2,应是发生酯化反应,则F为醇,D中含有4个碳原子,所以F中含有9个碳原子,F的分子式为C9H12O,E可以发生银镜反应,含有-CHO,在催化剂存在条件下1mol E与2mol H2反应可以生成F,F分子中含有苯环但无甲基,可推知E为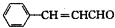 ,F为
,F为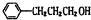 ,则G为
,则G为 .
.
解答 解:有机物A发生信息中的反应生成B,A应属于烃类,其相对分子质量为56,则$\frac{56}{12}$=4…8,可知A的分子式为C4H8,A的核磁共振氢谱有2组峰且峰面积之比为1:3,B可以连续发生氧化反应,则A为(CH3)2C=CH2,B的结构简式为(CH3)2CHCH2OH,C的结构简式为(CH3)2CHCHO,D的结构简式为(CH3)2CHCOOH,D和F反应生成有机物C13H18O2,应是发生酯化反应,则F为醇,D中含有4个碳原子,所以F中含有9个碳原子,F的分子式为C9H12O,E可以发生银镜反应,含有-CHO,在催化剂存在条件下1mol E与2mol H2反应可以生成F,F分子中含有苯环但无甲基,可推知E为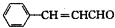 ,F为
,F为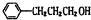 ,则G为
,则G为 .
.
(1)A为(CH3)2C=CH2,A中所含官能团的名称为碳碳双键,A生成B的反应类型是加成反应,
故答案为:碳碳双键;加成反应;
(2)由上述分析可知,C的结构简式为(CH3)2CHCHO,
故答案为:(CH3)2CHCHO;
(3)D与F反应是酯化反应,反应方程式为: ,
,
E发生银镜反应的离子方程式为: +2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$
+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ +2Ag↓+3NH3+NN4++H2O,
+2Ag↓+3NH3+NN4++H2O,
故答案为: ;
; +2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$
+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ +2Ag↓+3NH3+NN4++H2O;
+2Ag↓+3NH3+NN4++H2O;
(4)F的同分异构体符合:①遇FeCl3溶液显紫色,说明含有酚羟基,②苯环上有两个取代基,F的同分异构体为 (邻、间、对3种),
(邻、间、对3种), (邻、间、对3种),所以共6种,
(邻、间、对3种),所以共6种,
故答案为:6; 等.
等.
点评 本题考查有机物推断,需要学生对给予的信息进行利用,是常见题型,侧重考查学生的分析推理能力,注意根据相对分子质量与转化关系确定A的结构,熟练掌握官能团的性质与转化,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 100g 30% CH3COOH溶液中含氢原子数为2NA | |
| B. | 标准状况下,11.2 L CCl4中含有C-Cl键的数目为2NA | |
| C. | 16gO3和O2混合物中含氢原子数为NA | |
| D. | 精炼铜过程中阳极质量减少6.4g时,电路中转移电子数等于0.2NA |
| A. | 8种 | B. | 16种 | C. | 22种 | D. | 24种 |
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O.
(2)滴定过程中操作滴定管的图示1正确的是A.
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度偏高(填“偏高”、“偏低”、或“不变”).
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol•L-1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
| 试验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究探究温度不同对反应速率的影响 b.实验1和3探究反应物浓度对该反应速率的影响. c.实验2和4探究催化剂对反应速率的影响 | |
| 体积(mL) | 浓度(mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |

(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 试验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因可用离子方程式表示为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
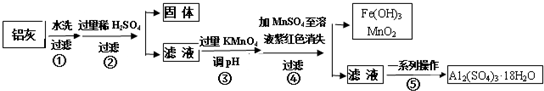
请回答下列问题:
(1)加入过量稀H2SO4溶解Al2O3的离子方程式是6H++Al2O3=2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(4)已知Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,常温下,当pH=2时,Fe3+开始沉淀的浓度为4.0×10-2mol/L.
(5)操作④发生反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(6)操作⑤“一系列操作”,下列仪器中用不到的是B(填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.
附表:相关物质的沸点(101KPa)
| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
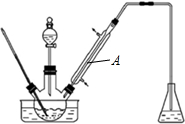
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机相用10%NaHCO3溶液洗涤.
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤.
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置A的名称是直型冷凝管,锥形瓶中的溶液应为NaOH.
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为AlCl3;
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的Br2、HCl(填化学式).
(4)步骤3中加入无水MgSO4固体的作用是除去有机相的水,分离的方法是过滤;
(5)步骤4中采用减压蒸馏技术,是为了防止间溴苯甲醛被氧化.
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
 ,D
,D ,E
,E .
.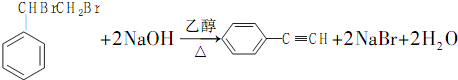 .
.