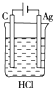
题目内容
 化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.(1)把化学能转化为电能的装置是
(2)甲烧杯中:
①石墨电极的电极式反应
②停止反应,取出Fe电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为
③反应停止后,欲使甲烧杯电解质溶液恢复至原状,应往溶液 中加入
(3)乙烧杯中:
①Fe电极是该装置的
②石墨电极上的电极反应式为
考点:原电池和电解池的工作原理
专题:
分析:(1)没有外接电源且能自发发生氧化还原反应的装置是原电池;
(2)①甲烧杯为电解池,石墨与正极相连为阳极,为溶液中的氢氧根失电子发生氧化反应;
②根据电极反应和电极上转移电子的数目相等进行计算;
③根据“析出什么加入什么”的原则判断;
(3)乙烧杯为电解池,所以铁为负极,铁本身失电子被氧化,碳为正极溶液中的铜离子得电子被还原.
(2)①甲烧杯为电解池,石墨与正极相连为阳极,为溶液中的氢氧根失电子发生氧化反应;
②根据电极反应和电极上转移电子的数目相等进行计算;
③根据“析出什么加入什么”的原则判断;
(3)乙烧杯为电解池,所以铁为负极,铁本身失电子被氧化,碳为正极溶液中的铜离子得电子被还原.
解答:
解:(1)没有外接电源且能自发发生氧化还原反应的装置是原电池,所以乙是原电池,故答案为:乙;
(2)①甲烧杯为电解池,石墨与正极相连为阳极,为溶液中的氢氧根失电子发生氧化反应,反应式为4OH--4e-═O2↑+2H2O,故答案为:4OH--4e-═O2↑+2H2O;
②取出Fe电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为
=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
则根据 4OH--4e-═O2↑+2H2O 所以V=
×22.4L/mol=0.112L,即112ml,
故答案为:112;
③由电解总反应为2CuSO4+2H2O
2Cu+O2↑+2H2SO4“析出什么加入什么”则应往溶液中加入CuO或者CuCO3,故答案为:CuO或者CuCO3;
(3)①乙烧杯为电解池,所以铁为负极,铁本身失电子被氧化,碳为正极溶液中的铜离子得电子被还原,故答案为:负;
②碳为正极溶液中的铜离子得电子被还原,电极反应为Cu2++2e-═Cu,故答案为:Cu2++2e-═Cu.
(2)①甲烧杯为电解池,石墨与正极相连为阳极,为溶液中的氢氧根失电子发生氧化反应,反应式为4OH--4e-═O2↑+2H2O,故答案为:4OH--4e-═O2↑+2H2O;
②取出Fe电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为
| 0.64g |
| 64g/mol |
则根据 4OH--4e-═O2↑+2H2O 所以V=
| 0.02mol |
| 4 |
故答案为:112;
③由电解总反应为2CuSO4+2H2O
| ||
(3)①乙烧杯为电解池,所以铁为负极,铁本身失电子被氧化,碳为正极溶液中的铜离子得电子被还原,故答案为:负;
②碳为正极溶液中的铜离子得电子被还原,电极反应为Cu2++2e-═Cu,故答案为:Cu2++2e-═Cu.
点评:本题考查了原电池和电解池原理,明确各个电极上发生的反应是解本题关键,知道原电池和电解池的区别,题目难度不大.

练习册系列答案
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
常温下,用水逐渐稀释0.1mol/L的醋酸(CH3COOH)溶液,下列数值不会逐渐增大的是( )
| A、c(CH3COOH) | ||
| B、n(H+) | ||
| C、c(H+) | ||
D、
|
S元素最可能是( )
| A、s区元素 | B、p区元素 |
| C、d区元素 | D、稀有气体元素 |
茫茫黑夜中,航标灯为航海员指明了方向.航标灯的电源必须长效、稳定.我国科技工作者研制出以铝合金、PtFe合金网为电极材料的海水电池.在这种电池中( )
①铝合金是阳极 ②铝合金是负极 ③海水是电解质溶液 ④铝合金电极发生还原反应.
①铝合金是阳极 ②铝合金是负极 ③海水是电解质溶液 ④铝合金电极发生还原反应.
| A、②③ | B、②④ | C、①③ | D、①④ |
储存浓硫酸的铁罐外口出现严重的腐蚀现象,这体现了浓硫酸的( )
| A、脱水性和吸水性 |
| B、吸水性和酸性 |
| C、强氧化性和吸水性 |
| D、不挥发性和酸性 |

 RCH2CHO+R′CH2CHO
RCH2CHO+R′CH2CHO
 ,R、R′表示烃基或氢原子;
,R、R′表示烃基或氢原子;