题目内容
某离子化合物A2B的总质子数为38,A离子比B离子少一个电子层,A离子的结构示意图为 ,B离子的电子式是 .用电子式表示A2B的形成过程: .
考点:原子结构与元素周期律的关系
专题:原子组成与结构专题
分析:离子化合物A2B的总质子数为38,平均数大于10,A离子比B离子少一个电子层,应为第三周期元素,A为金属,B为非金属,A化合价为+1价,应为Na,B为-2价,应为S,以此解答该题.
解答:
解:离子化合物A2B的总质子数为38,平均数大于10,A离子比B离子少一个电子层,应为第三周期元素,A为金属,B为非金属,A化合价为+1价,应为Na,B为-2价,应为S,A离子的结构示意图为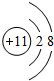 ,B离子的电子式是
,B离子的电子式是 ,电子式表示A2B的形成过程为
,电子式表示A2B的形成过程为 ,
,
故答案为: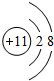 ;
; ;
; .
.
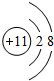 ,B离子的电子式是
,B离子的电子式是 ,电子式表示A2B的形成过程为
,电子式表示A2B的形成过程为 ,
,故答案为:
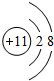 ;
; ;
; .
.
点评:本题主要考查了结构示意图、电子式、化学键、离子反应等,难度不大,元素推断是解题的关键,答题时注意正确使用化学用语.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列常见的反应,在理论上不能用于设计原电池的是( )
| A、H2SO4(aq)+BaCI2(aq)═2HCl(aq)+BaSO4(s) |
| B、CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l) |
| C、4Fe(OH)2(S)+2H2O(l)+O2(g)═4Fe(OH)3 |
| D、2H2(g)+O2(g)═2H2O(l) |
下列物质中含有非极性共价键的离子化合物是( )
| A、Ba(OH)2 |
| B、CaCl2 |
| C、H2O |
| D、Na2O2 |
下列符号表示的微粒中易与
X形成离子键的是( )
39 19 |
A、
| ||
B、
| ||
C、
| ||
D、
|
下列微粒中,中子数和质子数相等的是( )
①18O;②12C;③26Mg;④40K;⑤40Ca.
①18O;②12C;③26Mg;④40K;⑤40Ca.
| A、①② | B、②⑤ | C、只有④ | D、③④ |
下列各组粒子中质子数和电子数均相同的是( )
| A、CH4、H2O、Na+ |
| B、F2、Ar、HCl |
| C、H3O+、NH4+、Na |
| D、O2-、Mg2+、Ne |
下列说法正确的是( )
| A、碱性:LiOH>NaOH>KOH>RbOH |
| B、金属性:Rb>K>Na>Li |
| C、和酸反应时Fe失2个e-,Na失1个e-则Fe的金属性强于Na |
| D、Rb不易与水反应放出H2 |
 化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.