题目内容
在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C+H2O(g)=CO+H2; ②CO+H2O(g)=CO2+H2;
(1)已知CO(g)+
O2(g)═CO2(g)△H=-283.0kJ/mol;
H2(g)+
O2(g)═H2O(g)△H=-285.8kJ/mol;写出上述CO与H2O(g)反应的热化学方程式:
(2)从反应混合物中分离出H2的方法通常是以碱液洗气,根据该工业生产的实际分析,最好选用下列哪种溶液作为吸收剂? ,理由是
A.氢氧化钠溶液 B.氨水 C.石灰水或石灰乳.
①C+H2O(g)=CO+H2; ②CO+H2O(g)=CO2+H2;
(1)已知CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
(2)从反应混合物中分离出H2的方法通常是以碱液洗气,根据该工业生产的实际分析,最好选用下列哪种溶液作为吸收剂?
A.氢氧化钠溶液 B.氨水 C.石灰水或石灰乳.
考点:用盖斯定律进行有关反应热的计算
专题:
分析:(1)已知:①CO(g)+
O2(g)═CO2(g)△H=-283.0kJ/mol;
②H2(g)+
O2(g)═H2O(g)△H=-285.8kJ/mol;
由盖斯定律可知,①-②可得CO(g)+H2O(g)=CO2(g)+H2(g)△H;
(2)以煤为主要原料的合成氨工业,该厂含有丰富的氨水资源,且吸收后形成碳铵,可取得较好的经济效益.
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
由盖斯定律可知,①-②可得CO(g)+H2O(g)=CO2(g)+H2(g)△H;
(2)以煤为主要原料的合成氨工业,该厂含有丰富的氨水资源,且吸收后形成碳铵,可取得较好的经济效益.
解答:
解:(1)已知:①CO(g)+
O2(g)═CO2(g)△H=-283.0kJ/mol;
②H2(g)+
O2(g)═H2O(g)△H=-285.8kJ/mol;
由盖斯定律可知,①-②可得CO(g)+H2O(g)=CO2(g)+H2(g)△H=-283.0kJ/mol-(-285.8kJ/mol)=+2.8kJ/mol,
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ/mol;
(2)根据该工业生产的实际,以煤为主要原料的合成氨工业,该厂含有丰富的氨水资源,且吸收后形成碳铵,碳铵是一种化肥,可取得较好的经济效益,
故答案为:B;该厂含有丰富的氨水资源,且吸收后形成碳铵,碳铵是一种化肥,可取得较好的经济效益.
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
由盖斯定律可知,①-②可得CO(g)+H2O(g)=CO2(g)+H2(g)△H=-283.0kJ/mol-(-285.8kJ/mol)=+2.8kJ/mol,
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ/mol;
(2)根据该工业生产的实际,以煤为主要原料的合成氨工业,该厂含有丰富的氨水资源,且吸收后形成碳铵,碳铵是一种化肥,可取得较好的经济效益,
故答案为:B;该厂含有丰富的氨水资源,且吸收后形成碳铵,碳铵是一种化肥,可取得较好的经济效益.
点评:本题考查了用盖斯定律进行有关反应热的计算,为高考高频考点,难度不大,掌握盖斯定律的含义和“加和法”求算热化学方程式的反应热是解题的关键.

练习册系列答案
相关题目
大理石是一种重要的化工原料,其主要成分可以反应生成一系列物质,如下图所示.
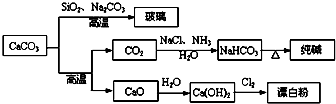
下列说法正确的是( )

下列说法正确的是( )
| A、Cl2和SO2均可以漂白有色物质,且漂白的原理相同 | ||||
B、由SiO2+Na2CO3
| ||||
| C、向饱和碳酸钠溶液中通入过量CO2,溶液变浑浊 | ||||
| D、制取玻璃和漂白粉所涉及的反应都是非氧化还原反应 |
漂白粉可由Cl2通入消石灰中制备.漂白粉的有效成分是( )
| A、Ca(OH)2 |
| B、CaCl2 |
| C、Ca(ClO)2 |
| D、CaCO3 |
天然气和液化石油气(主要成分为C3~C5的烷烃)燃烧的化学方程式分别为:CH4+2O2
CO2+2H2O,C3H8+5O2
CO2+4H2O,现有一套以天然气为燃料的灶具,今改用液化石油气,应采取的正确措施是( )
| 点燃 |
| 点燃 |
| A、增大空气进入量或减小石油气进入量 |
| B、增大空气进入量或增大石油气进入量 |
| C、减小空气进入量或减小石油气进入量 |
| D、减小空气进入量或增大石油气进入量 |
下列常见的反应,在理论上不能用于设计原电池的是( )
| A、H2SO4(aq)+BaCI2(aq)═2HCl(aq)+BaSO4(s) |
| B、CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l) |
| C、4Fe(OH)2(S)+2H2O(l)+O2(g)═4Fe(OH)3 |
| D、2H2(g)+O2(g)═2H2O(l) |
下列物质中含有非极性共价键的离子化合物是( )
| A、Ba(OH)2 |
| B、CaCl2 |
| C、H2O |
| D、Na2O2 |
下列说法正确的是( )
| A、碱性:LiOH>NaOH>KOH>RbOH |
| B、金属性:Rb>K>Na>Li |
| C、和酸反应时Fe失2个e-,Na失1个e-则Fe的金属性强于Na |
| D、Rb不易与水反应放出H2 |
 化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.