题目内容
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.请回答下列问题:
(1)在这些元素中,最不活泼的是 ,非金属性最强的是 ,金属性最强的是 ;(填元素符号或化学式,下同.)
(2)在这些元素中形成的最高价氧化物对应的水化物中,碱性最强的是 ,酸性最强的是 ;
(3)①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为 ;
(4)⑥的简单氢化物的电子式为 ,①在空气中燃烧后生成产物的电子式 ;
(5)用电子式表示③和⑧形成化合物的过程: .
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ② |
(2)在这些元素中形成的最高价氧化物对应的水化物中,碱性最强的是
(3)①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为
(4)⑥的简单氢化物的电子式为
(5)用电子式表示③和⑧形成化合物的过程:
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置知①为Na、②为K、③为Mg、④为Al、⑤为C、⑥为O、⑦为F、⑧为Cl、⑨为Ar.
(1)稀有气体最不活泼;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强;
(2)上述元素中K的金属性最强,故氢氧化钾的碱性最强,酸性最强的是高氯酸;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(4)⑥的简单氢化物为H2O,分子中O原子与H原子之间形成1对共用电子对;①在空气中燃烧后生成产物为Na2O2,由钠离子与过氧根离子构成;
(5)③和⑧形成化合物为MgCl2,由镁离子与氯离子构成,用Mg原子、Cl原子电子式表示其形成.
(1)稀有气体最不活泼;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强;
(2)上述元素中K的金属性最强,故氢氧化钾的碱性最强,酸性最强的是高氯酸;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(4)⑥的简单氢化物为H2O,分子中O原子与H原子之间形成1对共用电子对;①在空气中燃烧后生成产物为Na2O2,由钠离子与过氧根离子构成;
(5)③和⑧形成化合物为MgCl2,由镁离子与氯离子构成,用Mg原子、Cl原子电子式表示其形成.
解答:
解:由元素在周期表中位置知①为Na、②为K、③为Mg、④为Al、⑤为C、⑥为O、⑦为F、⑧为Cl、⑨为Ar.
(1)稀有气体Ar的化学性质最不活泼;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,故上述元素中F的非金属性最强,K的金属性最强,故答案为:Ar;F;K;
(2)上述元素中K的金属性最强,故KOH的碱性最强,酸性最强的是HClO4,故答案为:KOH;HClO4;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K>Na>Mg>Al>C,故答案为:K>Na>Mg>Al>C;
(4)⑥的简单氢化物为H2O,分子中O原子与H原子之间形成1对共用电子对,电子式为 ;①在空气中燃烧后生成产物为Na2O2,由钠离子与过氧根离子构成,电子式为:
;①在空气中燃烧后生成产物为Na2O2,由钠离子与过氧根离子构成,电子式为: ,故答案为:
,故答案为: ;
; ;
;
(5)③和⑧形成化合物为MgCl2,由镁离子与氯离子构成,用Mg原子、Cl原子电子式表示其形成为: ,
,
故答案为: .
.
(1)稀有气体Ar的化学性质最不活泼;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,故上述元素中F的非金属性最强,K的金属性最强,故答案为:Ar;F;K;
(2)上述元素中K的金属性最强,故KOH的碱性最强,酸性最强的是HClO4,故答案为:KOH;HClO4;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K>Na>Mg>Al>C,故答案为:K>Na>Mg>Al>C;
(4)⑥的简单氢化物为H2O,分子中O原子与H原子之间形成1对共用电子对,电子式为
 ;①在空气中燃烧后生成产物为Na2O2,由钠离子与过氧根离子构成,电子式为:
;①在空气中燃烧后生成产物为Na2O2,由钠离子与过氧根离子构成,电子式为: ,故答案为:
,故答案为: ;
; ;
;(5)③和⑧形成化合物为MgCl2,由镁离子与氯离子构成,用Mg原子、Cl原子电子式表示其形成为:
 ,
,故答案为:
 .
.
点评:本题考查元素周期表与元素周期律,侧重对元素周期律与电子式的考查,难度中等,注意掌握用电子式表示化学键或物质的形成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
人体血液的PH为维持在7.35~7.45,适量的CO2对维持这个PH变化范围其主要作用,其原理可用化学方程式表示:H2O+CO2=H++HCO3-.又知人体在正常情况下呼出的气体中CO2的体积分数约为5%,下了说法中正确的是( )
| A、安静状态下,长时间太快且太深的呼吸可以使呼出的气体中CO2的体积分数大于5% |
| B、人在痛苦中,长时间太深的呼吸可导致血液PH降低 |
| C、人在安静状态下,长时间太浅的呼吸可以导致血液PH降低 |
| D、窒息而死的人血液PH高于7.45 |
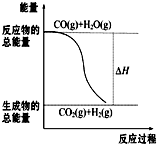 燃烧热是指一定条件下1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.已知热化学方程式:①CO(g)+
燃烧热是指一定条件下1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.已知热化学方程式:①CO(g)+| 1 |
| 2 |
| 1 |
| 2 |
| A、由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2 kJ?mol-1 | ||
| B、H2的燃烧热为241.8 kJ?mol-1 | ||
| C、H2(g)转变成H2O(g)的化学反应一定要释放能量 | ||
D、根据②推知反应H2(g)+
|
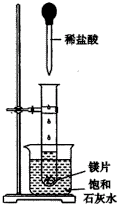 如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:
如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答: 将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol?L-1的NaOH溶液.当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2=650mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750mL时,沉淀量不再改变.
将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol?L-1的NaOH溶液.当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2=650mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750mL时,沉淀量不再改变.