题目内容
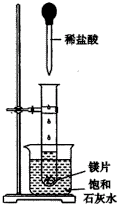 如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:
如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:(1)实验中观察到的现象是
A.试管中镁片逐渐溶解
B.试管中产生无色气泡
C.烧杯外壁变冷
D.烧杯底部析出少量白色固体
(2)试管中发生的反应属于
(3)由实验推知,MgCl2溶液和H2的总能量
考点:镁的化学性质,氧化还原反应,反应热和焓变
专题:化学反应中的能量变化
分析:如图所示的实验中,所试管内滴入稀盐酸,盐酸与镁剧烈反应放出氢气,同时反应放出的热量使饱和石灰水溶液温度升高,温度升高氢氧化钙溶解度减小,饱和溶液析出固体氢氧化钙而使溶液看上去变浑浊.
解答:
解:(1)镁与盐酸剧烈反应,产生氢气并放出大量的热,由于氢氧化钙的溶解度随温度升高而减小,所以饱和石灰水升温后析出的氢氧化钙使溶液呈浑浊状,镁条溶解,故ABD选项中的现象符合;
故答案为:ABD;
(2)镁与盐酸发生置换反应,生成氯化镁和氢气,反应的化学方程式为Mg+2HCl═MgCl2+H2↑,反应前后元素化合价变化属于氧化还原反应;
故答案为:氧化还原反应;
(3)当反应物的能量高于生成物的能量时,反应是放热反应,故MgCl2溶液和H2的总能量小于镁片的盐酸的总能量,故答案为:小于.
故答案为:ABD;
(2)镁与盐酸发生置换反应,生成氯化镁和氢气,反应的化学方程式为Mg+2HCl═MgCl2+H2↑,反应前后元素化合价变化属于氧化还原反应;
故答案为:氧化还原反应;
(3)当反应物的能量高于生成物的能量时,反应是放热反应,故MgCl2溶液和H2的总能量小于镁片的盐酸的总能量,故答案为:小于.
点评:本题通过化学变化放热而使饱和溶液温度升高,此类本题之一巧;饱和溶液为溶解度随温度升高而减小的氢氧化钙的饱和溶液,此为本题又一巧;抓住二巧是解决问题的关键,题目较简单.

练习册系列答案
相关题目
BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,合成方法有如下两种下列说法错误的是( )
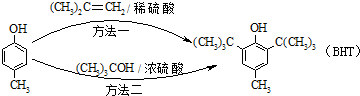

A、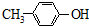 能与Na2CO3溶液反应 能与Na2CO3溶液反应 |
B、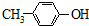 与BHT互为同系物 与BHT互为同系物 |
| C、BHT久置于空气中会被氧化 |
| D、两种方法的反应类型都是加成反应 |
用已知浓度的NaOH溶液滴定待测浓度的盐酸(盐酸置于锥形瓶中),以下操作会造成所测盐酸溶液浓度偏低的是( )
| A、酸式滴定管未用待装溶液润 |
| B、碱式滴定管未用待装溶液润洗 |
| C、滴定前平视滴定管刻度线,滴定终了仰视刻度线 |
| D、在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 |
下列说法正确的是( )
| A、蔗糖水解只生成葡萄糖 |
| B、含有碳碳双键的有机物均存在顺反异构现象 |
| C、向混有苯酚的苯中加入金属Na有无色气体生成 |
| D、用酸性高锰酸钾溶液检验CH2=CHCHO中是否含有醛基放电充电 |
下列能大量共存于溶液中的一组离子是( )
| A、Fe3+、K+、SCN-、SO42- |
| B、Fe3+、Fe2+、H+、S2- |
| C、Mg2+、Fe2+、OH-、NO3- |
| D、Na+、Fe3+、NO3-、Cl- |
NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、1 L 1 mol?L-1的氯化铁溶液中铁离子的数目为NA |
| B、标准状况下,2.24L CH2Cl2含有的分子数为0.1NA |
| C、78g Na2O2固体与足量H2O反应转移的电子数为NA |
| D、t℃时,1L pH=6的纯水中OH-的数目为10-8NA |
A、B、C、D、E五种元素为同周期的主族元素,且从左到右按原子序数的递增(原子序数为五个连续的自然数)的顺序排列如下:下列说法正确的是( )
| A | B | C | D | E |
| A、若C的最高价氧化物的水化物为强酸,则D元素肯定是活泼的非金属元素 |
| B、若A(OH)n为强碱,则B(OH)m也一定为强碱 |
| C、若C的最高正化合价为+5价,则A一定为金属元素 |
| D、若D的最低负化合价为-2价,则E的最高正价为+7价 |
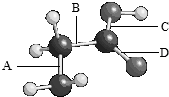 如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.
如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.