题目内容
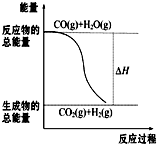 燃烧热是指一定条件下1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.已知热化学方程式:①CO(g)+
燃烧热是指一定条件下1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.已知热化学方程式:①CO(g)+| 1 |
| 2 |
| 1 |
| 2 |
| A、由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2 kJ?mol-1 | ||
| B、H2的燃烧热为241.8 kJ?mol-1 | ||
| C、H2(g)转变成H2O(g)的化学反应一定要释放能量 | ||
D、根据②推知反应H2(g)+
|
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、据已知方程式,利用盖斯定律解答;
B、燃烧热中H生成液态水;
C、据已知反应,利用盖斯定律②-①得一热化学方程式;
D、放热越多△H越小.
B、燃烧热中H生成液态水;
C、据已知反应,利用盖斯定律②-①得一热化学方程式;
D、放热越多△H越小.
解答:
解:A、已知热化学方程式:①CO(g)+
O2(g)═CO2(g)△H=-283.0kJ?mol-1②H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1据盖斯定律,①-②得:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2 kJ?mol-1,故A正确;
B、H的燃烧热必须是生成液态水时放出的热量,所以氢气的燃烧热数值应大于241.8 kJ?mol-1,故B错误;
C、已知热化学方程式:①CO(g)+
O2(g)═CO2(g)△H=-283.0kJ?mol-1②H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1,据盖斯定律,②-①得:H2(g)+CO2(g)=H2O(g)+CO(g)△H=+41.2KJ/mol,故C错误;
D、生成液态水比生成水蒸气放热多,放热越多焓变越小,H2(g)+
O2(g)═H2O(l)△H<-241.8 kJ?mol-1,故D错误;
故选A.
| 1 |
| 2 |
| 1 |
| 2 |
B、H的燃烧热必须是生成液态水时放出的热量,所以氢气的燃烧热数值应大于241.8 kJ?mol-1,故B错误;
C、已知热化学方程式:①CO(g)+
| 1 |
| 2 |
| 1 |
| 2 |
D、生成液态水比生成水蒸气放热多,放热越多焓变越小,H2(g)+
| 1 |
| 2 |
故选A.
点评:本题考查了盖斯定律、燃烧热、放热越多焓变越小,注意放热反应的焓变小于0,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
无色的有机物I是印制防伪商标的一种原料,在紫外光辐射下Ⅰ可转变成结构Ⅱ(显橙色),反应如下(R1、R2、R3是烃基):有关上述变化的说法不正确的是( )
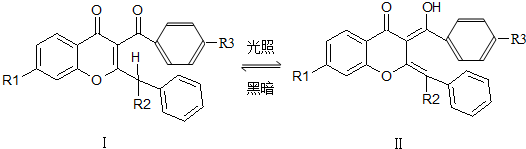

| A、Ⅰ和Ⅱ互为同分异构体 |
| B、Ⅰ、Ⅱ分子中所有原子都可能在同一平面上 |
| C、Ⅱ可看作醇类 |
| D、Ⅱ能发生加成反应 |
有一种稀烃与H2按物质的量比1:1加成后得到了 则该稀烃的结构式可能有( )
则该稀烃的结构式可能有( )
 则该稀烃的结构式可能有( )
则该稀烃的结构式可能有( )| A、1种 | B、2种 | C、3种 | D、4种 |
加入铝粉能放出H2的溶液中肯定不能大量共存的离子组是( )
| A、Fe3+、NO3-、Cl-、NH4+ |
| B、Ba2+、Mg2+、HCO3-、Cl-? |
| C、SO42-、Cl-、K+、NH4+ |
| D、SO32-、K+、AlO2-、Na+ |
某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成.在恒温、恒压的条件下,将此混合气体通过浓硫酸时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色.则混合气体一定含的成份是( )
| A、HCl、CO和CO2 |
| B、HCl、H2和CO |
| C、CH4和NH3 |
| D、HCl和CO |
 现有反应:mA(g)+B(g)?2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
现有反应:mA(g)+B(g)?2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则: