题目内容
为了配制一种需含NaH2PO4和Na2HPO4(它们的物质的量之比为3:1)的培养液,已知每升混合液中含磷元素0.10mol.现在用4.0mol?L-1的磷酸溶液和固体NaOH反应来配制2.0L混合液,求需该磷酸溶液的体积和NaOH的质量.
考点:化学方程式的有关计算
专题:计算题
分析:用4.0mol?L-1的磷酸溶液和固体NaOH反应来配制2.0L混合液,H3PO4可与氢氧化钠反应生成NaH2PO4或Na2HPO4;每升混合液中含磷元素0.10mol,2.0L该混合液含有磷元素0.2mol,则反应后n(NaH2PO4)+n(Na2HPO4)=0.2mol,而NaH2PO4和Na2HPO4物质的量比为3:1,则n(NaH2PO4)=0.15mol,n(Na2HPO4)=0.05mol,根据磷、钠原子守恒,以此计算n(H3PO4)进而计算磷酸溶液的体积、n(NaOH)的物质的量,进而计算质量.
解答:
解:用4.0mol?L-1的磷酸溶液和固体NaOH反应来配制2.0L混合液,H3PO4可与氢氧化钠反应生成NaH2PO4或Na2HPO4;则反应后n(NaH2PO4)+n(Na2HPO4)=0.2mol,而NaH2PO4和Na2HPO4物质的量比为3:1,则n(NaH2PO4)=0.2mol×
=0.15mol,n(Na2HPO4)=0.2mol×
=0.05mol,
由磷元素守恒可知需要n(H3PO4)=n(NaH2PO4)+n(Na2HPO4)=0.15mol+0.05mol=0.2mol,
磷酸溶液的体积V=
=
=0.05L=50mL,
由钠元素守恒可知需要n(NaOH)=n(NaH2PO4)+2n(Na2HPO4)=0.15mol+0.1mol=0.25mol,
则m(NaOH)=0.25mol×40g/mol=10g,
答:该磷酸溶液的体积为50mL,NaOH的质量为10g.?
| 3 |
| 1+3 |
| 1 |
| 3+1 |
由磷元素守恒可知需要n(H3PO4)=n(NaH2PO4)+n(Na2HPO4)=0.15mol+0.05mol=0.2mol,
磷酸溶液的体积V=
| n |
| c |
| 0.2mol |
| 4.0mol/L |
由钠元素守恒可知需要n(NaOH)=n(NaH2PO4)+2n(Na2HPO4)=0.15mol+0.1mol=0.25mol,
则m(NaOH)=0.25mol×40g/mol=10g,
答:该磷酸溶液的体积为50mL,NaOH的质量为10g.?
点评:本题考查元素化合物的计算,根据磷、钠原子守恒是解答本题的关键,题目难度不大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
A、B、C、D、E五种元素为同周期的主族元素,且从左到右按原子序数的递增(原子序数为五个连续的自然数)的顺序排列如下:下列说法正确的是( )
| A | B | C | D | E |
| A、若C的最高价氧化物的水化物为强酸,则D元素肯定是活泼的非金属元素 |
| B、若A(OH)n为强碱,则B(OH)m也一定为强碱 |
| C、若C的最高正化合价为+5价,则A一定为金属元素 |
| D、若D的最低负化合价为-2价,则E的最高正价为+7价 |
盛有N2和NO2混合气体25毫升的量筒,倒立于盛有水的水槽中,过一段时间后,气体的体积不再变化,测得气体体积为15毫升,则原混合气体中N2和NO2的体积比是( )
| A、3:2 | B、1:4 |
| C、2:3 | D、3:1 |
由Na2SO4和NaNO3组成的混合物88g溶于水配制成1L溶液,此溶液中Na+的浓度为1.2mol/L,则原混合物中NaNO3的质量为( )
| A、17g | B、34g |
| C、25.5g | D、51g |
下列物质的电子式书写正确的是( )
A、 |
B、 |
C、 |
D、 |
无色的有机物I是印制防伪商标的一种原料,在紫外光辐射下Ⅰ可转变成结构Ⅱ(显橙色),反应如下(R1、R2、R3是烃基):有关上述变化的说法不正确的是( )
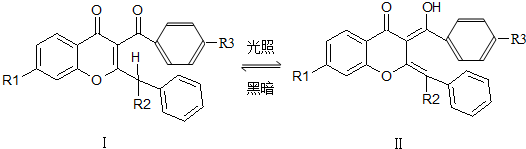

| A、Ⅰ和Ⅱ互为同分异构体 |
| B、Ⅰ、Ⅱ分子中所有原子都可能在同一平面上 |
| C、Ⅱ可看作醇类 |
| D、Ⅱ能发生加成反应 |
加入铝粉能放出H2的溶液中肯定不能大量共存的离子组是( )
| A、Fe3+、NO3-、Cl-、NH4+ |
| B、Ba2+、Mg2+、HCO3-、Cl-? |
| C、SO42-、Cl-、K+、NH4+ |
| D、SO32-、K+、AlO2-、Na+ |