题目内容
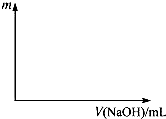 将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol?L-1的NaOH溶液.当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2=650mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750mL时,沉淀量不再改变.
将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol?L-1的NaOH溶液.当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2=650mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750mL时,沉淀量不再改变.(1)最初加入的50mLNaOH溶液的作用是什么?
(2)画出沉淀量(m)随NaOH溶液体积滴入量的变化关系,并计算所用硫酸的浓度.
(3)试判断两种氧化物各是什么,并计算其物质的量.
考点:化学方程式的有关计算
专题:计算题
分析:(1)开始没有沉淀生成,说明加入的氢氧化钠溶液由于中和过量的硫酸;
(2)根据沉淀量与氢氧化钠溶液体积作图,注意开始产生沉淀、沉淀最大时、沉淀量减小到不变时消耗氢氧化钠溶液的体积;
沉淀量最大时,溶液中溶质为硫酸钠,由钠离子守恒2n(Na2SO4)=n(NaOH),由硫酸根守恒n(H2SO4)=n(Na2SO4),进而计算硫酸的物质的量浓度;
(3)沉淀达最大时,再进行滴入NaOH溶液,沉淀部分溶解,故氧化物一定含有Al2O3,根据氢氧化铝溶解消耗氢氧化钠计算氢氧化铝的物质的量,再根据Al元素守恒计算n(Al2O3),计算铝离子沉淀消耗NaOH物质的量,进而计算生成另一种氢氧化物时消耗NaOH的物质的量,结合两种氧化物的物质的量相等,确定令一种氧化物中金属的化合价,且该氢氧化物不溶于过量碱溶液中,据此判断解答.
(2)根据沉淀量与氢氧化钠溶液体积作图,注意开始产生沉淀、沉淀最大时、沉淀量减小到不变时消耗氢氧化钠溶液的体积;
沉淀量最大时,溶液中溶质为硫酸钠,由钠离子守恒2n(Na2SO4)=n(NaOH),由硫酸根守恒n(H2SO4)=n(Na2SO4),进而计算硫酸的物质的量浓度;
(3)沉淀达最大时,再进行滴入NaOH溶液,沉淀部分溶解,故氧化物一定含有Al2O3,根据氢氧化铝溶解消耗氢氧化钠计算氢氧化铝的物质的量,再根据Al元素守恒计算n(Al2O3),计算铝离子沉淀消耗NaOH物质的量,进而计算生成另一种氢氧化物时消耗NaOH的物质的量,结合两种氧化物的物质的量相等,确定令一种氧化物中金属的化合价,且该氢氧化物不溶于过量碱溶液中,据此判断解答.
解答:
解:(1)开始没有沉淀生成,说明加入的氢氧化钠溶液由于中和过量的硫酸,
答:最初加入的50mLNaOH溶液的作用是:中和过量的硫酸;
(2)当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2=650mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750mL时,沉淀量不再改变,则沉淀量与氢氧化钠溶液体积关系图为:
沉淀量最大时,溶液中溶质为硫酸钠,由钠离子守恒:2n(Na2SO4)=n(NaOH)=1.00mol?L-1×0.650L=0.650mol,由硫酸根守恒n(H2SO4)=n(Na2SO4)=
×0.65mol=0.325mol,故硫酸的浓度为
=3.25mol/L,
答:沉淀量(m)随NaOH溶液体积滴入量的变化关系图为 ;硫酸的浓度为3.25mol/L;
;硫酸的浓度为3.25mol/L;
(3)沉淀达最大时,再进行滴入NaOH溶液,沉淀部分溶解,故氧化物一定含有Al2O3,根据Al(OH)3+OH-=AlO2-+2H2O,该反应用去的n(NaOH)=1.00mol?L-1×(0.75-0.65)L=0.1mol,故Al(OH)3为0.1mol,由Al元素守恒n(Al2O3)=0.05mol;
根据Al3++3OH-═Al(OH)3,生成Al(OH)3用去0.3mol NaOH.而生成另一种氢氧化物用去NaOH为1.00mol?L-1×(0.65-0.05)L-0.3mol=0.3mol,且已知两种氧化物的物质的量相等,故另一种氧化物也是三价金属的氧化物,且氢氧化物不溶于过量碱溶液中,可知其为Fe2O3,Fe2O3的物质的量为0.05mol,
答:氧化物为Al2O3、Fe2O3,物质的量均为0.05mol
答:最初加入的50mLNaOH溶液的作用是:中和过量的硫酸;
(2)当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2=650mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750mL时,沉淀量不再改变,则沉淀量与氢氧化钠溶液体积关系图为:

沉淀量最大时,溶液中溶质为硫酸钠,由钠离子守恒:2n(Na2SO4)=n(NaOH)=1.00mol?L-1×0.650L=0.650mol,由硫酸根守恒n(H2SO4)=n(Na2SO4)=
| 1 |
| 2 |
| 0.325mol |
| 0.1L |
答:沉淀量(m)随NaOH溶液体积滴入量的变化关系图为
 ;硫酸的浓度为3.25mol/L;
;硫酸的浓度为3.25mol/L;(3)沉淀达最大时,再进行滴入NaOH溶液,沉淀部分溶解,故氧化物一定含有Al2O3,根据Al(OH)3+OH-=AlO2-+2H2O,该反应用去的n(NaOH)=1.00mol?L-1×(0.75-0.65)L=0.1mol,故Al(OH)3为0.1mol,由Al元素守恒n(Al2O3)=0.05mol;
根据Al3++3OH-═Al(OH)3,生成Al(OH)3用去0.3mol NaOH.而生成另一种氢氧化物用去NaOH为1.00mol?L-1×(0.65-0.05)L-0.3mol=0.3mol,且已知两种氧化物的物质的量相等,故另一种氧化物也是三价金属的氧化物,且氢氧化物不溶于过量碱溶液中,可知其为Fe2O3,Fe2O3的物质的量为0.05mol,
答:氧化物为Al2O3、Fe2O3,物质的量均为0.05mol
点评:本题考查混合物计算、无机物推断等,侧重考查学生对知识的迁移运用能力,需要学生熟练掌握元素化合物知识,难度中等.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、1 L 1 mol?L-1的氯化铁溶液中铁离子的数目为NA |
| B、标准状况下,2.24L CH2Cl2含有的分子数为0.1NA |
| C、78g Na2O2固体与足量H2O反应转移的电子数为NA |
| D、t℃时,1L pH=6的纯水中OH-的数目为10-8NA |
盛有N2和NO2混合气体25毫升的量筒,倒立于盛有水的水槽中,过一段时间后,气体的体积不再变化,测得气体体积为15毫升,则原混合气体中N2和NO2的体积比是( )
| A、3:2 | B、1:4 |
| C、2:3 | D、3:1 |
由Na2SO4和NaNO3组成的混合物88g溶于水配制成1L溶液,此溶液中Na+的浓度为1.2mol/L,则原混合物中NaNO3的质量为( )
| A、17g | B、34g |
| C、25.5g | D、51g |
无色的有机物I是印制防伪商标的一种原料,在紫外光辐射下Ⅰ可转变成结构Ⅱ(显橙色),反应如下(R1、R2、R3是烃基):有关上述变化的说法不正确的是( )
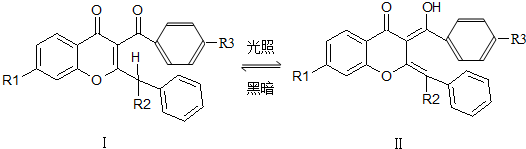

| A、Ⅰ和Ⅱ互为同分异构体 |
| B、Ⅰ、Ⅱ分子中所有原子都可能在同一平面上 |
| C、Ⅱ可看作醇类 |
| D、Ⅱ能发生加成反应 |
 现有反应:mA(g)+B(g)?2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
现有反应:mA(g)+B(g)?2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则: