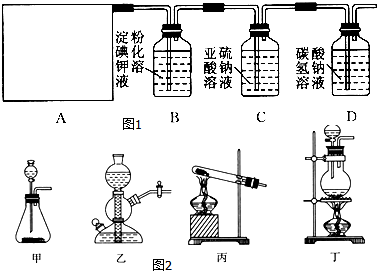
题目内容
7.25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=5.1×10-9.在该温度下,下列说法不正确的是( )| A. | 若误饮c(Ba2+)=1.0×10-5mol/L溶液时,不会引起Ba2+中毒 | |
| B. | 因为Ksp(BaCO3)>Ksp(BaSO4),所以BaCO3不能作内服造影剂 | |
| C. | 向同浓度Na2SO4和Na2CO3的混合溶液中滴加BaCl2溶液,BaSO4先析出 | |
| D. | 在BaSO4和BaCO3共存的悬浊液中,c(SO42-):c(CO32-)=1:51 |
分析 A.c(Ba2+)=1.0×10-5 mol•L-1的溶液钡离子浓度很小;
B.BaCO3可溶于盐酸;
C.化学式相似的物质Ksp小的容易生成沉淀;
D.根据Ksp(BaSO4 和Ksp(BaCO3)计算可求出.
解答 解:A.c(Ba2+)=1.0×10-5 mol•L-1的溶液,钡离子浓度很小,不会引起钡离子中毒,故A正确;
B.BaCO3可溶于盐酸,可引入钡离子中毒,与溶度积大小无关,故B错误;
C.25℃时,Ksp(BaSO4)=1×10-10,Ksp (BaCO3)=5.1×10-9,物质Ksp小的容易生成沉淀,所以同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出,故C正确;
D.根据Ksp(BaSO4 )和Ksp(BaCO3)计算可求出中c(SO42-):c(CO32-)=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=1:51,故D正确.
故选B.
点评 本题考查了沉淀之间的转化,沉淀溶解平衡的移动,Ksp的有关计算,综合性较强,题目难度中等,注意把握沉淀溶解平衡的原理及影响因素是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.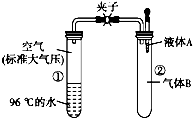 如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 饱和食盐水、氯化氢 | ||
| C. | 氢氧化钠溶液、一氧化碳 | D. | 石灰水、二氧化硫 |
15.我国规定饮用水质量标准必须符合下列要求:
以下是源水处理成自来水的工艺流程示意图:
源水→曝气池$\stackrel{加石灰}{→}$一级沉降池$→_{通入CO_{2}}^{凝聚剂井}$二级沉降池$\stackrel{气体A}{→}$过滤池→自来水
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式Mg2++OH-=Mg(OH)2↓.
(2)凝聚剂除去悬浮固体颗粒的过程③(填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3沉淀.
(3)通入二氧化碳的目的是将Ca2+除去和调整溶液中的pH达到饮用水质量标准.
(4)气体A的作用是杀菌消毒.这种作用是基于气体A和水反应的产物具有强氧化性.
(5)下列物质中,①和③可以作为气体A的代用品.(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
| pH | 6.5~6.8 |
| Ca2+、Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/L |
源水→曝气池$\stackrel{加石灰}{→}$一级沉降池$→_{通入CO_{2}}^{凝聚剂井}$二级沉降池$\stackrel{气体A}{→}$过滤池→自来水
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式Mg2++OH-=Mg(OH)2↓.
(2)凝聚剂除去悬浮固体颗粒的过程③(填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3沉淀.
(3)通入二氧化碳的目的是将Ca2+除去和调整溶液中的pH达到饮用水质量标准.
(4)气体A的作用是杀菌消毒.这种作用是基于气体A和水反应的产物具有强氧化性.
(5)下列物质中,①和③可以作为气体A的代用品.(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
12.四种短周期元素A、B、C、D的性质或结构信息如下.
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
请根据上述信息回答下列问题.
(1)甲、乙、丙中含有的共同元素是氢(填名称).
(2)B元素在周期表中的位置为第2周期ⅣA族.
(3)上述元素的原子M层有一个未成对p电子的是Cl(填元素符号).
(4)丙的电子式为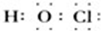 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
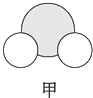 | 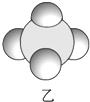 |  |
| 是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
(1)甲、乙、丙中含有的共同元素是氢(填名称).
(2)B元素在周期表中的位置为第2周期ⅣA族.
(3)上述元素的原子M层有一个未成对p电子的是Cl(填元素符号).
(4)丙的电子式为
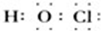 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
19.1mol甲烷和一定物质的量的氯气混合均匀,以漫射光照射使之发生取代反应.甲烷的取代反应所得有机产物都是很好的有机溶剂.假设反应后甲烷与氯气均无剩余,且生成了等物质的量的四种有机取代产物,则参加反应的氯气的物质的量为( )
| A. | 1.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
16.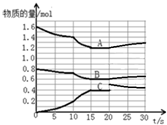 在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
 在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )| A. | 反应在前10s 内v(B)=0.005mol/(L.s) | |
| B. | 方程式计量数a:b:c为2:1:2 | |
| C. | 10 s时改变条件可能是升高温度,20s时平衡逆向进行 | |
| D. | 15~20s间,反应的平衡常数是2.7 |
 某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.