题目内容
7.某同学用下面的装置制备并收集纯净的氯化铁,硬质玻璃管E中装有细铁丝网.
试回答:
(1)检验装置A的气密性的方法是用酒精灯微热圆底烧瓶,一段时间后,C中导管冒气泡,停止加热后,导管中水柱回流一段,说明气密性好
(2)装置A中反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(3)装置C的作用是:吸收HCl,装置D中的试剂是:浓硫酸.
(4)可检验装置E中生成的物质中阳离子的方法及现象是硫氰化钾溶液(苯酚溶液、氢氧化钠溶液),显红色(紫色、产生红褐色沉淀).
(5)若把氯气通入石蕊溶液中,观察的现象是:先变红后褪色.
(6)装置 G中发生反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O.
分析 实验室制取Cl2通常利用下面的反应原理:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,在如图的装置中,A是Cl2发生装置,B中是浓盐酸,A中是MnO2,C、D为气体的净化装置,C中装有饱和食盐水除去氯气中的氯化氢,D中装有浓H2SO4,是吸收氯气中的水蒸气,E是硬质玻璃管中装有细铁丝网,氯气通过会发生反应生成氯化铁,F为干燥的广口瓶是用来收集氯气的集气瓶,烧杯G为尾气吸收装置,氢氧化钠溶液吸收防止氯气污染空气,以此解答该题.
解答 解:实验室制取Cl2通常利用下面的反应原理:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,在如图的装置中,A是Cl2发生装置,B中是浓盐酸,A中是MnO2,C、D为气体的净化装置,C中装有饱和食盐水除去氯气中的氯化氢,D中装有浓H2SO4,是吸收氯气中的水蒸气,E是硬质玻璃管中装有细铁丝网,氯气通过会发生反应生成氯化铁,F为干燥的广口瓶是用来收集氯气的集气瓶,烧杯G为尾气吸收装置,氢氧化钠溶液吸收防止氯气污染空气,
(1)检验装置A的气密性的方法为:用酒精灯微热圆底烧瓶,一段时间后,C中导管冒气泡,停止加热后,导管中水柱回流一段,说明气密性好,
故答案为:用酒精灯微热圆底烧瓶,一段时间后,C中导管冒气泡,停止加热后,导管中水柱回流一段,说明气密性好;
(2)装置A中二氧化锰与浓盐酸在加热条件下生成氯气、氯化锰和水,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)C、D为气体的净化装置,C中装有饱和食盐水除去氯气中的氯化氢,D中装有浓H2SO4,是吸收氯气中的水蒸气,
故答案为:吸收HCl;浓硫酸;
(4)装置E中生成的物质中阳离子为铁离子,检验铁离子的方法为:硫氰化钾溶液(苯酚溶液、氢氧化钠溶液),显红色(紫色、产生红褐色沉淀),
故答案为:硫氰化钾溶液(苯酚溶液、氢氧化钠溶液),显红色(紫色、产生红褐色沉淀);
(5)氯气与水反应生成氯化氢和次氯酸,所以氯水具有酸性和漂白性,若把氯气通入石蕊溶液中,溶液会先变红后褪色,
故答案为:先变红后褪色;
(6)烧杯G为尾气吸收装置,氢氧化钠溶液吸收防止氯气污染空气,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了制备方案的设计,题目难度中等,明确实验目的及实验原理为解答关键,注意掌握氯气的制备方法及化学性质,试题培养了学生的分析、理解能力及化学实验能力.

| A. | 铂电极做成网状,可增大与氧气的接触面积 | |
| B. | 该电池通常只需要更换铝板就可继续使用 | |
| C. | 海洋电池中铝板充当负极,发生氧化反应 | |
| D. | 负极反应为:O2+H20+2e-=2OH- |
| A. | Y、Z的氧化物都有两性 | |
| B. | 气态氢化物的稳定性:Z>X | |
| C. | 原子半径:W>Y>Z>X | |
| D. | 最高价氧化物对应水化物的碱性:W<Y |

实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36qo盐酸15mL、水.
(1)反应①的化学方程式为NH4[CuCl2]=CuCl↓+NH4Cl,用95%乙醇代替蒸馏水洗涤的主要目的是避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分.
(2)本实验中通入O2的速率不宜过大,为便于观察和控制产生02的速率,宜选择图3中的B(填字母序号)方案.
(3)实验开始时,温度计显示反应液温度低于室温,主要原因是氯化铵溶于水吸收大量热量;电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色;当烧瓶上方红棕色气体逐渐变为无色时停止通入氧气,打开瓶塞,沿a或c(填字母)口倾出棕色反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题有防止CuCl被氧化,避光防止分解.
(5)氯化亚铜的定量分析:
①称取样品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;玻璃珠的作用是加速样品的溶解.
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0mol.L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表.
(已知:CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+═Fe3++Ce3+)
| 实验序号 | 1 | 2 | 3 |
| 滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
| 滴定终点读数(mL) | 24.65 | 24.75 | 24.70 |
| A. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 | |
| B. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
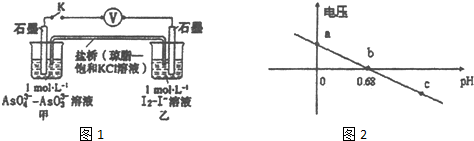
| A. | pH=5 时,负极电极反应式为2I--2e-═I2 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | a点时,盐桥中K+向左移动 | |
| D. | pH>0.68时,氧化性I2>AsO43- |
Ⅰ、通过分析,对白色产物成分的可能情况提出了如下几种假设:
假设1:白色产物为Na2O
假设2:白色产物为Na2CO3
假设3:白色产物为Na2O和Na2CO3混合物
Ⅱ、为验证假设3正确,该小组同学设计了如下实验,请你帮他们完成下表内容.
限选试剂:蒸馏水、2mol/L H2SO4、BaCl2溶液、澄清石灰水、酚酞试剂、稀盐酸等;实验仪器任选.
| 实验步骤 | 预期现象及结论 |
①若假设2正确,则金属钠在二氧化碳中燃烧的化学方程式为:4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
②有同学认为如果CO2足量则不会生成黑色物质,且白色产物成分也可以确定.此时的化学方程式为:2Na+2CO2$\frac{\underline{\;点燃\;}}{\;}$Na2CO3+CO.

 的系统名称是3,4-二甲基-3-乙基己烷.
的系统名称是3,4-二甲基-3-乙基己烷. .
. 形成该高聚物的单体的结构简式分别为
形成该高聚物的单体的结构简式分别为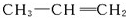 、
、 .
.