题目内容
4.下列各项表述得不够科学严密的是( )| A. | 有电子转移(得失或偏移)的化学反应都是氧化还原反应 | |
| B. | p电子原子轨道的平均半径随电子层的增大而增大 | |
| C. | 电子是在原子核外,能量由低到高的不同电子层上分层排布的 | |
| D. | 氢原子电子云图中小黑点表示电子的运动轨迹 |
分析 A、氧化还原反应一定有电子转移或偏移;
B、原子轨道半径随着电子层的增大而增大;
C、原子核外电子是遵循能量最低原理,能量低的在离原子核近的区域运动;
D、小黑点本身没有意义,不代表1个电子,也不代表出现次数,小黑点的疏密表示出现机会的多少.
解答 解:A、电子转移或偏移是氧化还原反应的实质,故A正确;
B、p电子原子轨道的平均半径随电子层的增大而增大,故B正确;
C、电子在原子核外,从能量低的依次由里向外排布,故C正确;
D、小黑点表示电子在核外空间某处出现的机会,不表示电子的运动轨迹,故D错误;
故选D.
点评 本题考查了氧化还原反应的实质,核外电子排布规律应用,电子云等,侧重于基础知识的考查,注意把握电子云的含义,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2和盐酸; Cu(OH)2和CH3COOH | |
| B. | BaCl2和Na2SO4; Ba(OH)2和CuSO4 | |
| C. | NaHCO3和NaHSO4 Na2CO3和NaHSO4 | |
| D. | NaHCO3( 过量)和Ca(OH)2 Ca(HCO3)2 和NaOH( 过量) |
7. 二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由上述数据计算△H1=-99 kJ•mol-1.
(2)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H
该反应△H=-263 kJ•mol-1,化学平衡常数K=K12•K2•K3(用含K1、K2、K3的代数式表示).
(3)下列措施中,能提高CH3OCH3产率的有AD.
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率.
(5)以$\frac{n({H}_{2})}{n(CO)}$=2 通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是CD.
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K=2.25.
 二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H
该反应△H=-263 kJ•mol-1,化学平衡常数K=K12•K2•K3(用含K1、K2、K3的代数式表示).
(3)下列措施中,能提高CH3OCH3产率的有AD.
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率.
(5)以$\frac{n({H}_{2})}{n(CO)}$=2 通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是CD.
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K=2.25.
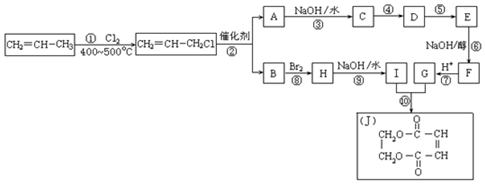
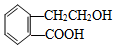 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.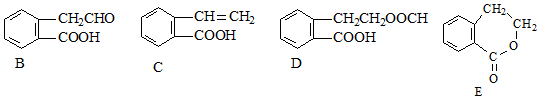
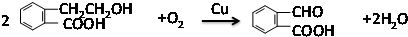 ,反应类型:氧化反应
,反应类型:氧化反应 ,反应类型:酯化反应
,反应类型:酯化反应 .
. .
. .
.
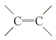 两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.
两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.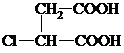 .
.