题目内容
已知NO+NO2+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO2+NaNO3+H2O.NO和NO2的混合气体的组成可表示为NOx,该混合气体通入NaOH溶液被完全吸收时,x的值为( )
| A、x≥1.5 | B、x=1.5 |
| C、x≤1.5 | D、无法确定 |
考点:氮的氧化物的性质及其对环境的影响
专题:计算题
分析:根据反应:NO+NO2+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO2+NaNO3+H2O,混合气体通入NaOH溶液被完全吸收时,应满足n(NO2)≥n(NO)即可.
解答:
解:由方程式可知混合气体通入NaOH溶液被完全吸收时,应满足n(NO2)≥n(NO),即x≥1.5,
故选A.
故选A.
点评:本题考查含氮化合物的性质,题目难度不大,本题关键是能够把握反应的特点,注意把握题给信息.

练习册系列答案
相关题目
下列化学用语表达正确的是( )
| A、碳酸钠的水解方程式:2H2O+CO32-?H2CO3+2OH- |
| B、碳酸的电离方程式:H2CO3?2H++CO32- |
| C、氯化铁发生水解的离子方程式:Fe3++3H2O?Fe (OH)3+3H+ |
| D、碳酸氢钠在水溶液中的电离:NaHCO3?Na++HCO3- |
下列说法正确的是( )
| A、羟基与氢氧根有相同的化学式和电子式 |
| B、乙醇的官能团是-OH,乙醇是含-OH的化合物 |
| C、常温下,1mol乙醇可与足量的Na反应生成11.2L H2 |
D、 已知乙醇的结构式如图所示,则乙醇催化氧化时断裂的化学键为②③ |
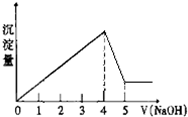 有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量之比为( )
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量之比为( )| A、1:1 | B、1:2 |
| C、1:3 | D、2:1 |
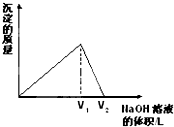 向aL一定浓度的AlCl3溶液中,逐滴加入c mol/L的NaOH溶液,生成沉淀的质量与滴入NaOH溶液体积的关系如图所示.下列代数式中不能表示AlCl3溶液中AlCl3的物质的量浓度的数值的是( )
向aL一定浓度的AlCl3溶液中,逐滴加入c mol/L的NaOH溶液,生成沉淀的质量与滴入NaOH溶液体积的关系如图所示.下列代数式中不能表示AlCl3溶液中AlCl3的物质的量浓度的数值的是( )A、
| ||
B、
| ||
C、
| ||
D、
|
将苯与溴水混合,充分振荡后静置,用分液漏斗分离出上层液体放置于一试管中,若向其中加入一种试剂,可发生反应并产生白雾,这种试剂可以是( )
| A、亚硫酸钠 | B、溴化铁 |
| C、锌粉 | D、铁粉 |
我国古代“药金”的冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”.下列叙述正确的是( )
| A、“药金”实质上是铜锌合金 |
| B、冶炼炉中炉甘石直接被木炭还原为锌 |
| C、用王水可区别黄金和“药金” |
| D、用火焰灼烧不能区别黄金和药金 |
下列烃及烃的高聚物:①乙烷;②苯;③聚丙烯;④聚-2-甲基-1,3-丁二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧石油裂解气,能使酸性KMnO4溶液褪色,也能与溴水反应而使溴水褪色的是( )
| A、②③④⑤⑥⑦⑧ | B、③④⑤⑥⑦⑧ |
| C、④⑤⑧ | D、④⑤⑦ |
