题目内容
我国古代“药金”的冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”.下列叙述正确的是( )
| A、“药金”实质上是铜锌合金 |
| B、冶炼炉中炉甘石直接被木炭还原为锌 |
| C、用王水可区别黄金和“药金” |
| D、用火焰灼烧不能区别黄金和药金 |
考点:金属冶炼的一般原理,合金的概念及其重要应用
专题:元素及其化合物
分析:A、根据“药金”的制取过程来确定其主要含有的金属;
B、冶炼炉中炉甘石分解成的氧化锌可以被木炭还原为锌;
C、铜锌都可以和王水反应,并王水能将黄金溶解;
D、金属元素的检验可以采用颜色反应法.
B、冶炼炉中炉甘石分解成的氧化锌可以被木炭还原为锌;
C、铜锌都可以和王水反应,并王水能将黄金溶解;
D、金属元素的检验可以采用颜色反应法.
解答:
解:A、根据质量守恒定律,反应前后元素种类不变和“药金”的冶炼材料可知:与黄金外观相似的“药金”主要成分是Zn、Cu,实质上是铜锌合金,故A正确;
B、冶炼炉中炉甘石先是在高温下分解为氧化锌,然后被被木炭还原为锌,故B错误;
C、铜锌都可以和王水反应,并且王水能将黄金溶解,所以王水不可区别黄金和“药金”,故C错误;
D、含有不同的金属元素的焰色反应会呈现不同的颜色,可以根据火焰灼烧时的颜色来区别黄金和药金,故D错误.
故选A.
B、冶炼炉中炉甘石先是在高温下分解为氧化锌,然后被被木炭还原为锌,故B错误;
C、铜锌都可以和王水反应,并且王水能将黄金溶解,所以王水不可区别黄金和“药金”,故C错误;
D、含有不同的金属元素的焰色反应会呈现不同的颜色,可以根据火焰灼烧时的颜色来区别黄金和药金,故D错误.
故选A.
点评:本题是一道信息给定题,注意金属性质的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
“绿色化学”提倡化工生产应尽可能将反应物的原子全部利用,从根本上解决环境污染问题.在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是( )
A、CH2=CH2+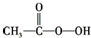 (过氧乙酸)→ (过氧乙酸)→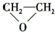 +CH3COOH +CH3COOH | ||
B、CH2=CH2+Cl2+Ca(OH)2→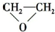 +CaCl2+H2O +CaCl2+H2O | ||
C、2CH2=CH2+O2
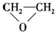 | ||
D、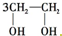
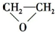 +HOCH2CH2-O-CH2CH2OH+2H2O +HOCH2CH2-O-CH2CH2OH+2H2O |
已知NO+NO2+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO2+NaNO3+H2O.NO和NO2的混合气体的组成可表示为NOx,该混合气体通入NaOH溶液被完全吸收时,x的值为( )
| A、x≥1.5 | B、x=1.5 |
| C、x≤1.5 | D、无法确定 |
下列说法中,正确的是( )
| A、物 质的化学反应与体系的能量变化不是同时发生的 |
| B、化学键可以使离子相结合,不可以使原子相结合 |
| C、在相同的温度和压强下,等体积的O2和O3含有相同数目的原子 |
| D、金属元素和非金属元素分界线附近的元素多用于制造半导体 |
 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是 ( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是 ( )| A、X原子可能为第ⅤA族元素 |
| B、Y原子一定为第ⅠA族元素 |
| C、该分子中,既含极性键,又含非极性键 |
| D、从圆球的大小分析,该分子可能为N2F4 |
下列实验中,不能达到预期目的是( )
①苯、浓溴水、溴化铁混合制溴苯
②乙醇和30%的硫酸共热到170℃制乙烯
③用溴水除去混在苯中的己烯,分液得到纯净的苯
④敞口久置的电石与饱和食盐水混合制乙炔
⑤将电石与水反应产生的乙炔通入溴水中,溴水褪色,证明乙炔和溴水发生了加成反应
⑥将溴乙烷和NaOH乙醇溶液混合共热,生成的气体直接通入酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色,说明有乙烯生成.
①苯、浓溴水、溴化铁混合制溴苯
②乙醇和30%的硫酸共热到170℃制乙烯
③用溴水除去混在苯中的己烯,分液得到纯净的苯
④敞口久置的电石与饱和食盐水混合制乙炔
⑤将电石与水反应产生的乙炔通入溴水中,溴水褪色,证明乙炔和溴水发生了加成反应
⑥将溴乙烷和NaOH乙醇溶液混合共热,生成的气体直接通入酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色,说明有乙烯生成.
| A、②④⑥ | B、①③⑤ |
| C、①②④⑥ | D、①②③④⑤⑥ |
在甲、乙、丙、丁四个烧杯中各加入100mL水,然后分别放入含有3.9g钾元素的金属钾、过氧化钾、超氧化钾(KO2)和氢氧化钾,待固体完全溶解.则甲、乙、丙、丁溶液的质量分数大小顺序是( )
| A、甲<乙<丙<丁 |
| B、丁<乙=丙<甲 |
| C、甲=丁<乙=丙 |
| D、甲>丙>乙>丁 |

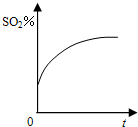
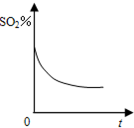
 碘及其化合物在生产、生活和科技等方面都有着重要的应用.回答下列问题:
碘及其化合物在生产、生活和科技等方面都有着重要的应用.回答下列问题: