题目内容
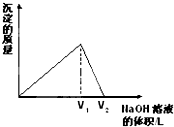 向aL一定浓度的AlCl3溶液中,逐滴加入c mol/L的NaOH溶液,生成沉淀的质量与滴入NaOH溶液体积的关系如图所示.下列代数式中不能表示AlCl3溶液中AlCl3的物质的量浓度的数值的是( )
向aL一定浓度的AlCl3溶液中,逐滴加入c mol/L的NaOH溶液,生成沉淀的质量与滴入NaOH溶液体积的关系如图所示.下列代数式中不能表示AlCl3溶液中AlCl3的物质的量浓度的数值的是( )A、
| ||
B、
| ||
C、
| ||
D、
|
考点:化学方程式的有关计算
专题:计算题
分析:开始AlCl3与NaOH反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到顶点时氢氧化钠体积为V1将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量n[Al(OH)3]=n[AlCl3]=
n(NaOH);
随后再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到V2点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失;Al3+~4OH-,此时n[AlCl3]=
n(NaOH)=
V2Cmol;
由于V1→V2消耗的氢氧化钠溶液体积为(V2-V1)L,消耗NaOH为(V2-V1)L×cmol/L=(V2-V1)Cmol,根据方程式可知n[Al(OH)3]=(V2-V1)Cmol,根据m=nM计算氢氧化铝的质量;根据铝原子守恒则n(AlCl3)═(V2-V1)Cmol,根据c=
计算氯化铝的物质的量浓度;
| 1 |
| 3 |
随后再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到V2点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失;Al3+~4OH-,此时n[AlCl3]=
| 1 |
| 4 |
| 1 |
| 4 |
由于V1→V2消耗的氢氧化钠溶液体积为(V2-V1)L,消耗NaOH为(V2-V1)L×cmol/L=(V2-V1)Cmol,根据方程式可知n[Al(OH)3]=(V2-V1)Cmol,根据m=nM计算氢氧化铝的质量;根据铝原子守恒则n(AlCl3)═(V2-V1)Cmol,根据c=
| n |
| V |
解答:
解:开始AlCl3与NaOH反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到顶点时氢氧化钠体积为V1将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量n[Al(OH)3]=n[AlCl3]=
n(NaOH)=V1Cmol,氯化铝的物质的量浓度c=
=
=
mol/L,故A正确;
随后再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到V2点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失;
Al3+~4OH-,此时n[AlCl3]=
n(NaOH)=
V2Cmol,氯化铝的物质的量浓度c=
=
mol/L=
mol/L,故B正确;故C错误;
由于V1→V2消耗的氢氧化钠溶液体积为(V2-V1)L,消耗NaOH为(V2-V1)L×cmol/L=(V2-V1)Cmol,根据方程式可知n[Al(OH)3]=(V2-V1)Cmol,根据m=nM计算氢氧化铝的质量;根据铝原子守恒则n(AlCl3)═(V2-V1)Cmol,氯化铝的物质的量浓度c=
=
mol/L,故D正确;
故选C.
| 1 |
| 3 |
| n |
| V |
| ||
| aL |
| CV1 |
| 3a |
随后再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到V2点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失;
Al3+~4OH-,此时n[AlCl3]=
| 1 |
| 4 |
| 1 |
| 4 |
| n |
| V |
| ||
| a |
| V2C |
| 4a |
由于V1→V2消耗的氢氧化钠溶液体积为(V2-V1)L,消耗NaOH为(V2-V1)L×cmol/L=(V2-V1)Cmol,根据方程式可知n[Al(OH)3]=(V2-V1)Cmol,根据m=nM计算氢氧化铝的质量;根据铝原子守恒则n(AlCl3)═(V2-V1)Cmol,氯化铝的物质的量浓度c=
| n |
| V |
| V2-V1 |
| a |
故选C.
点评:本题是AlCl3与NaOH反应与图象相结合的计算问题,考查了对图象的解读能力,分析问题能力、计算能力等,难度中等,本题解决的关键是明确NaOH溶液逐滴加入到AlCl3溶液中的反应情况.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
用NA表示阿伏加德罗数的值,下列叙述正确的是( )
| A、浓度为1mol/L的Al2(SO4)3溶液中Al3+的数目为2NA |
| B、室温下,21.0g乙烯和丁烯(C4H8)的混合气体中含有的碳原子数目为1.5NA |
| C、0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA |
| D、标准状况下,22.4L乙醇中含有的氧原子数为1.0NA |
22.5g某油脂皂化时需要3g NaOH,则该油脂的式量为( )
| A、450 | B、600 |
| C、900 | D、300 |
高氯酸是最强的酸,质量分数为60%的高氯酸溶液加热不分解,浓度增高就不稳定,受热易分解,热、浓的高氯酸溶液遇有机物易爆炸,纯高氯酸的沸点是130℃.现有市售的70%高氯酸,为使其进一步浓缩,所采取的措施正确的是( )
| A、加入浓硫酸后再小心常压蒸馏 |
| B、各仪器连接处的橡皮塞应塞紧防止漏气 |
| C、加入浓硫酸后再减压蒸馏 |
| D、加入浓硫酸后再加压蒸馏 |
海水是巨大的化学资源库,下列有关海水综合利用说法正确的是( )
| A、从海水中可以得到NaCl,电解熔融NaCl可制备金属Na |
| B、海水蒸发制海盐的过程中只发生了化学变化 |
| C、海水的淡化,只需经过化学变化就可以得到 |
| D、利用海水、铝、空气的航标灯的原理是将电能转化为化学能 |
已知NO+NO2+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO2+NaNO3+H2O.NO和NO2的混合气体的组成可表示为NOx,该混合气体通入NaOH溶液被完全吸收时,x的值为( )
| A、x≥1.5 | B、x=1.5 |
| C、x≤1.5 | D、无法确定 |
植物油水解后,高级脂肪酸的成分是( )
| A、油酸的成分多 |
| B、硬脂酸的成分多 |
| C、软脂酸的成分多 |
| D、甘油的成分多 |
 如图是实验室模拟煤的干馏的实验装置,下列有关叙不正确的是( )
如图是实验室模拟煤的干馏的实验装置,下列有关叙不正确的是( )| A、图示实验中发生了化学反应 |
| B、实验后水溶液的pH>7,溶液Y是黑色黏稠的煤焦油,上层X是粗苯等 |
| C、气体Z中有些成分易燃,且可以还原氧化铜 |
| D、液体Y是一种纯净物 |
 碘及其化合物在生产、生活和科技等方面都有着重要的应用.回答下列问题:
碘及其化合物在生产、生活和科技等方面都有着重要的应用.回答下列问题: