题目内容
下列说法正确的是( )
| A、羟基与氢氧根有相同的化学式和电子式 |
| B、乙醇的官能团是-OH,乙醇是含-OH的化合物 |
| C、常温下,1mol乙醇可与足量的Na反应生成11.2L H2 |
D、 已知乙醇的结构式如图所示,则乙醇催化氧化时断裂的化学键为②③ |
考点:烃的衍生物官能团,乙醇的化学性质
专题:有机化学基础
分析:A.羟基的化学式为:-OH,羟基中氧原子周围7个电子;氢氧根离子化学式为:OH-,氢氧根离子为阴离子;
B.乙醇由-OH和-C2H5构成,-OH是乙醇的官能团;
C.标准状况下,1mol乙醇可与足量的Na反应生成11.2L H2;
D.根据乙醇性质分析.
B.乙醇由-OH和-C2H5构成,-OH是乙醇的官能团;
C.标准状况下,1mol乙醇可与足量的Na反应生成11.2L H2;
D.根据乙醇性质分析.
解答:
解:A.羟基的化学式为:-OH,氧原子与氢原子通过一对共用电子对连接,羟基中的氧原子含有一个未成对电子,电子式为: ;
;
氢氧根离子化学式为:OH-,氢氧根离子为带有1个单位负电荷的阴离子,需要标出离子中各原子最外层电子,氢氧根离子的电子式为: ;故A错误;
;故A错误;
B.乙醇由-OH和-C2H5构成,-OH是乙醇的官能团,故B正确;
C.标准状况下,1mol乙醇可与足量的Na反应生成11.2L H2,常温下,产生氢气体积大于11.2L,故C错误;
D.乙醇催化氧化断键部位为①③,故D错误,故选B.
 ;
;氢氧根离子化学式为:OH-,氢氧根离子为带有1个单位负电荷的阴离子,需要标出离子中各原子最外层电子,氢氧根离子的电子式为:
 ;故A错误;
;故A错误;B.乙醇由-OH和-C2H5构成,-OH是乙醇的官能团,故B正确;
C.标准状况下,1mol乙醇可与足量的Na反应生成11.2L H2,常温下,产生氢气体积大于11.2L,故C错误;
D.乙醇催化氧化断键部位为①③,故D错误,故选B.
点评:本题考察了乙醇结构和性质,羟基是乙醇的官能团,乙醇的性质由官能团羟基决定,注意断键部位.

练习册系列答案
 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
若阿伏伽德罗常数的数值用NA表示,下列说法正确的是( )
| A、标准状况下,1.12L氦气所含原子数为0.1NA |
| B、1.6gNH2-离子所含质子数为NA |
| C、22.4LHCI溶于水,溶液中H数为NA |
| D、9gD2O所含的中子数为4.5NA |
“绿色化学”提倡化工生产应尽可能将反应物的原子全部利用,从根本上解决环境污染问题.在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是( )
A、CH2=CH2+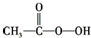 (过氧乙酸)→ (过氧乙酸)→ +CH3COOH +CH3COOH | ||
B、CH2=CH2+Cl2+Ca(OH)2→ +CaCl2+H2O +CaCl2+H2O | ||
C、2CH2=CH2+O2
 | ||
D、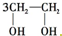
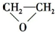 +HOCH2CH2-O-CH2CH2OH+2H2O +HOCH2CH2-O-CH2CH2OH+2H2O |
22.5g某油脂皂化时需要3g NaOH,则该油脂的式量为( )
| A、450 | B、600 |
| C、900 | D、300 |
高氯酸是最强的酸,质量分数为60%的高氯酸溶液加热不分解,浓度增高就不稳定,受热易分解,热、浓的高氯酸溶液遇有机物易爆炸,纯高氯酸的沸点是130℃.现有市售的70%高氯酸,为使其进一步浓缩,所采取的措施正确的是( )
| A、加入浓硫酸后再小心常压蒸馏 |
| B、各仪器连接处的橡皮塞应塞紧防止漏气 |
| C、加入浓硫酸后再减压蒸馏 |
| D、加入浓硫酸后再加压蒸馏 |
已知NO+NO2+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO2+NaNO3+H2O.NO和NO2的混合气体的组成可表示为NOx,该混合气体通入NaOH溶液被完全吸收时,x的值为( )
| A、x≥1.5 | B、x=1.5 |
| C、x≤1.5 | D、无法确定 |
 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是 ( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是 ( )| A、X原子可能为第ⅤA族元素 |
| B、Y原子一定为第ⅠA族元素 |
| C、该分子中,既含极性键,又含非极性键 |
| D、从圆球的大小分析,该分子可能为N2F4 |