题目内容
17.下列有关实验能成功的是( )| A. | 苯加到溴水中,将会和溴发生取代反应而使溴水褪色 | |
| B. | 用冷却结晶法来提纯含少量KCl杂质的KNO3晶体 | |
| C. | 将10%的葡萄糖溶液加到新制氢氧化铜悬浊液中,出现砖红色沉淀 | |
| D. | 进行淀粉水解实验时,为检验水解产物和水解程度,加液顺序为淀粉溶液→H2SO4溶液→NaOH溶液→碘水→新制Cu(OH)2悬浊液 |
分析 A.苯与溴水不反应;
B.二者溶解度受温度影响不同;
C.葡萄糖与氢氧化铜的反应在碱性条件下,且加热;
D.检验水解产物葡萄糖在碱性条件下,另取少量溶液加碘水检验是否含淀粉.
解答 解:A.苯与溴水不反应,混合发生萃取,为物理变化,故A错误;
B.二者溶解度受温度影响不同,则用冷却结晶法来提纯含少量KCl杂质的KNO3晶体,故B正确;
C.葡萄糖与氢氧化铜的反应在碱性条件下,且加热,则10%的葡萄糖溶液加到新制氢氧化铜悬浊液中无现象,故C错误;
D.检验水解产物葡萄糖在碱性条件下,另取少量溶液加碘水检验是否含淀粉,而NaOH溶液与碘水反应,无法检验是否有淀粉剩余,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、有机物的检验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
3.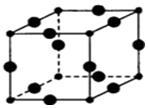 (1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.
(1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.
(2)基态磷原子核外有15种运动状态不同的电子.
(3)CO的结构可表示为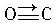 与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).
与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).
(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
则KCl、MgO、CaO三种晶体的熔点从高到低的顺序是MgO>CaO>KCl.其中MgO晶体中一个Mg2+周围和它最近且等距离的Mg2+有12个.
(5)Cu3N的晶胞结构如图,N3-的配位数为6,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为$\frac{103}{4{N}_{A}(a+b)^{3}}$g•cm-3.(阿伏加德罗常数用NA表示)
 (1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.
(1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.(2)基态磷原子核外有15种运动状态不同的电子.
(3)CO的结构可表示为
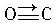 与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).
与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3 401 |
(5)Cu3N的晶胞结构如图,N3-的配位数为6,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为$\frac{103}{4{N}_{A}(a+b)^{3}}$g•cm-3.(阿伏加德罗常数用NA表示)
8.下列关于有机化合物的说法正确的是( )
| A. | 正丁烷与2-甲基丁烷互为同分异构体 | |
| B. | 聚乙烯能使溴的四氯化碳溶液褪色,发生的反应是加成反应 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,但在FeBr3存在下能与液溴发生取代反应 | |
| D. | 除去乙酸乙酯中残留的乙酸,有效的处理方法是水洗后分液 |
5.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):H2(g)+Cl2(g)→2HCl(g)+Q1KJ H2(g)+Br2(g)→2HBr(g)+Q2KJ 根据上述反应做出的判断不正确的是( )
| A. | Q1>Q2 | |
| B. | 生成物总能量均低于反应物总能量 | |
| C. | 生成 2mol HCl(g)放出 Q1KJ 热量 | |
| D. | 若反应生成 2mol 液态溴化氢,放出的热量低于 Q2KJ |
12.四种短周期元素在周期表中的相对位置如表所示,其中 Z 元素原子核外电子总数是其 最外层电子数的 3 倍.下列说法中不正确的是( )
| X | Y | |
| Z | W |
| A. | X、Y 均能形成不止一种氢化物 | |
| B. | YO 2是一种有毒气体,属于酸性氧化物 | |
| C. | Y 的最简单氢化物比 Z 的稳定性更强 | |
| D. | XW2中各原子最外层均达到 8e-稳定结构 |
2.化学与生产、生活密切相关.下列说法中正确的是( )
| A. | 油脂、糖类、蛋白质中产生能量最高的营养物质是蛋白质 | |
| B. | “从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| C. | 纯碱可用于制造玻璃,也可用于除去物品表面油污 | |
| D. | 废旧电池必须回收,主要目的是回收其中的金属 |
6.重水(${\;}_{1}^{2}$H2O)是重要的核工业原料,关于氘原子(${\;}_{1}^{2}$H)说法正确的是( )
| A. | 通过化学变化可实现${\;}_{1}^{2}$H与${\;}_{1}^{1}$H的相互转化 | |
| B. | ${\;}_{1}^{2}$H与${\;}_{1}^{1}$H的核外电子排布方式相同,化学性质相同 | |
| C. | ${\;}_{1}^{2}$H与${\;}_{1}^{1}$H核外电子数和中子数均为1 | |
| D. | ${\;}_{1}^{2}$H与H2互为同素异形体 |
7.将Na2O2与过量NaHCO3混合固体在密闭容器中充分加热反应后,排出气体后最终剩余固体是( )
| A. | NaOH和Na2O2 | B. | NaOH和Na2CO3 | C. | Na2CO3 | D. | Na2O2 |
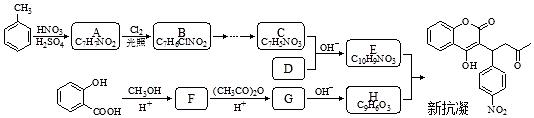
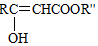
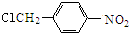 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$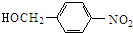 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$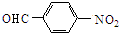 .
.